
| A. | 乙醇和乙酸 | B. | 乙酸乙酯和乙醇 | C. | 苯和乙酸乙酯 | D. | 四氯化碳和溴苯 |
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: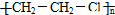 | |
| D. | 氯化铵的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | KW/c(H+)=10-10 mol•L-1的溶液中:Na+、HCO3-、Cl-、K+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
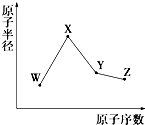 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料.Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料.Z的非金属性在同周期元素中最强.下列说法正确的是( )| A. | 对应简单离子半径:X>W | |
| B. | 对应气态氢化物的稳定性:Y>Z | |
| C. | 化合物XZW既含离子键,又含共价键,属于弱电解质 | |
| D. | Y的氧化物和Z的氢化物均能与X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
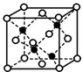 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使元素的化合态转化成游离态的过程可能是还原的过程 | |
| B. | 高炉炼铁的原料有铁矿石、焦炭和空气.工业上就是用焦炭还原铁矿石以制得生铁 | |
| C. | 电解熔融氧化铝时,每还原出2.7kg铝,必有300mol电子转移 | |
| D. | 工业上常用电解熔融NaCl的方法制取金属钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com