
【题目】Ⅰ.催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
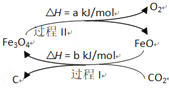
整个过程中Fe3O4的作用是________________________________。
(2)已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。按n(N2)∶n(H2) = 1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:
2NH3(g) ΔH<0。按n(N2)∶n(H2) = 1∶3向反应容器中投料,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:
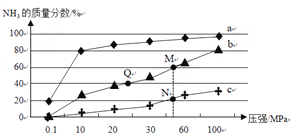
①下列说法正确的是__________。(填字母)
a.曲线a、b、c对应的温度是由低到高
b.加入催化剂能加快化学反应速率和提高H2的转化率
c.图中Q、M、N点的平衡常数:K(N)>K(Q)=K(M)
②M点对应H2的转化率是__________。
③2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
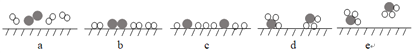
![]() 、
、![]() 和
和![]() 分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是____________和______________。
分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是____________和______________。
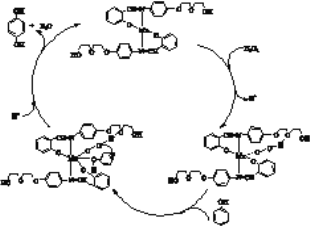
(3)有机反应中也常用到催化剂。某反应原理可以用下图表示,写出此反应的化学方程式_____________________________。
Ⅱ.过二硫酸钾(K2S2O8)在科研与工业上有重要用途。
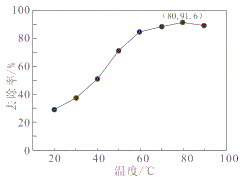
(4)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理燃煤锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。一定条件下,NO去除率随温度变化的关系如图所示。80℃时,若NO初始浓度为450 mg·m-3,t min达到最大去除率,NO去除的平均反应速率:v(NO)=__________mol·L-1·Min-1(列代数式,不必计算结果)
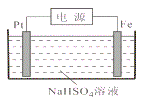
(5)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如图所示。
常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
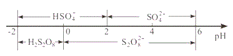
在阳极放电的离子主要是HSO4,阳极区电解质溶液的pH范围为___________,阳极的电极反应式为_____________。
【答案】 中间产物 a 60% N2、H2被吸附在催化剂表面 在催化剂表面,N2、H2分子中化学键断裂 ![]() + H2O2
+ H2O2![]()
![]() + H2O
+ H2O ![]() (或
(或![]() 或
或![]() ) 0~2 2HSO4--2e-=S2O42-+2H+
) 0~2 2HSO4--2e-=S2O42-+2H+
【解析】Ⅰ.(1)将CO2转化为炭黑进行回收利用,根据反应过程I、II,整个过程中Fe3O4的是一个中间产物,故其作用是中间产物;
(2)①该反应为放热反应,压强相同时,升高温度,平衡逆向移动,氨气质量分数减小,故曲线a、b、c对应的温度是由低到高,故a正确;b.加入催化剂能加快化学反应速率但不能影响平衡移动不会提高H2的转化率,故b错误;c.图中Q、M温度相同,K(Q)=K(M),N点比M点温度高,平衡逆向移动,平衡常数减小,故K(N)<K(Q)=K(M),故c错误;故选a;
②M点时,氨气的转化率是60%, n(N2)∶n(H2) = 1∶3,设n(N2)=1mol,n(H2)=3mol 气体总质量为34g
故平衡时n(NH3)=1.2mol
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol) 1 3 0
转化(mol) 0.6 1.8 1.2
平衡(mol) 0.4 1.2 1.2
H2的转化率:![]() ×100%=60%;
×100%=60%;
③根据图示![]() 、
、![]() 和
和![]() 分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是
分别表示N2、H2和NH3。e表示生成的NH3离开催化剂表面,b和c的含义分别是
N2、H2被吸附在催化剂表面 、在催化剂表面,N2、H2分子中化学键断裂;
(3)由图示可知:反应物为![]() 和H2O2,生成物是
和H2O2,生成物是![]() 和H2O ,故方程式为:
和H2O ,故方程式为:![]() + H2O2
+ H2O2![]()
![]() + H2O ;
+ H2O ;
(4) NO初始浓度为450 mg·m-3,物质的量浓度是1.5×10-5mol/L,80℃时,t min达到最大去除率为91.6%,NO去除的平均反应速率:v(NO)=![]() =
=![]() mol·L-1·min-1;
mol·L-1·min-1;
(5) 在阳极放电的离子主要是HSO4-,根据阳极区含硫微粒的主要存在形式与pH的关系,电解质溶液的pH范围为0~2,阳极失电子,故HSO4-失电子生成S2O42-,故其电极反应为:2HSO4--2e-=S2O42-+2H+。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述正确的是
A. 周期表中有8个A族,8个B族
B. 目前使用的元素周期表中,最长的周期含有32种元素
C. 短周期元素是指1-20号元素
D. 原子及其离子的核外电子层数都等于该元素所在的周期数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法中不正确的是

A. 左边的电极为电池的负极,a处通入的是甲醇
B. 每消耗3.2 g氧气转移的电子为0.4 mol
C. 电池负极的反应式为CH3OH+H2O6e===CO2+6H+
D. 电池的正极反应式为O2+2H2O+4e===4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成.下列说法正确的是( )
A.O2和O3互为同位素
B.O2和O3的相互转化是物理变化
C.在相同的温度与压强下,等体积的O2和O3含有相同的分子数
D.等物质的量的O2和O3含有相同的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的元素,如:钛(22Ti)、铁(26Fe)、砷、硒、锌等及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为___________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有______种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是______________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
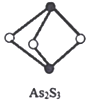
(4)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如图,As原子的杂化方式为____________,雌黄和SnCl2在盐酸中反应转化为雌黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式__________________________。SnCl4分子的空间构型为______________。
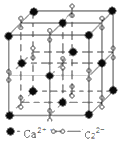
(5)高子化合物CaC2的一种晶体结构如图所示。该物质的电子式___________。一个晶胞含有的π键平均有___________个。
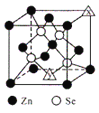
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com