
分析 金属钠和H2反应生成甲,则甲为NaH,具有还原性,可与水反应生成NaOH和氢气,
(1)甲为钠和氢气反应的产物,为NaH;
(2)NaH与AlCl3反应可得到NaAlH4;
(3)NaAlH4与水反应生成氢气,应是水中的H元素与NaH中的H元素之间得失电子;
(4)制备过程中未指明吸收杂质气体HCl,据此解答;氢气与金属钠反应未指明钠的用量,钠可能过量,过量的钠也可以与水反应生成氢气.
解答 解:(1)Na在化合价中呈现+1价,故该物质的化学式可能为NaH,又甲与AlCl3反应可得到NaAlH4,Al的化合价为+3,故H元素的化合价为-1,4.80g甲加热至完全分解,得到金属钠和2.24L,即0.1mol氢气,
化学反应方程式为:2NaH$\frac{\underline{\;加热\;}}{\;}$2Na+H2↑
48g 22.4L
4.8g 2.24L
故此化合物为NaH,
故答案为:NaH;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,根据原子守恒推测另一种生成物,化学反应方程式为:4NaH+AlCl3=NaAlH4+3NaCl,
故答案为:4NaH+AlCl3=NaAlH4+3NaCl;
(3)NaAlH4与水反应生成氢气,即NaH中H化合价升高,水中H元素化合价降低,化学反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,
故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;
(4)稀盐酸具有挥发性,且可以利用浓硫酸干燥,故制取的氢气中可能混有杂质气体HCl,那么制取的甲中就混有NaCl,验证过程中未排除金属钠的干扰,过量的金属能也可以与水反应生成氢气.
故答案为:制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
点评 本题主要考查的是常见元素以及其化合物的知识,为高频考点,和常见题型,综合性较强,涉及化学式的书写、物质的判断、氧化还原反应、化学反应方程式书写等,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、SO42-、NO3- | B. | Fe3+、A13+、Cl-、HS- | ||
| C. | Na+、A1O2-、Na+、HCO3- | D. | K+、Na+、MnO4-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
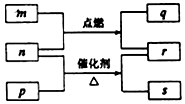 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | |
| B. | 简单氢化物沸点:X<Y<Z | |
| C. | m与q、n与s均不能共存 | |
| D. | W、X、Y、Z四种元素可组合成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁和锌分别与相同浓度的盐酸反应,镁产生H2的速率快 | |
| B. | 铜与浓硝酸反应生成NO2,与稀硝酸反应生成NO | |
| C. | 面粉加工厂内充满粉尘遇火易发生爆炸 | |
| D. | 用加热的方法可以将水中溶解的O2和N2赶出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Cl2>Br2>Cr2O72- | B. | 氧化性:Cr2O72->Cl2>Fe3+ | ||
| C. | 还原性:SO2<Fe2+<Br- | D. | 还原性:Cl->Cr3+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
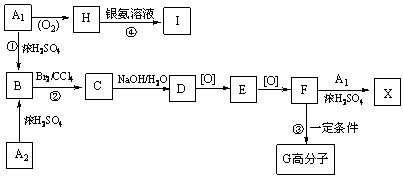
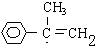 ; G
; G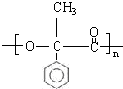 .反应C→D属于取代反应(填反应类型)
.反应C→D属于取代反应(填反应类型)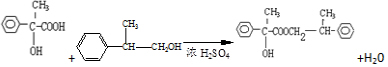 ;H→I反应的化学方程式
;H→I反应的化学方程式 .
.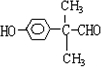 (任写一种即可).
(任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com