

| A. | X单质最稳定 | B. | Y的氢化物为HY | ||
| C. | Z单质常温下是淡黄色固体 | D. | 能生成HXO |
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 右图是可逆反应N2(g)+3H2(g)═2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )
右图是可逆反应N2(g)+3H2(g)═2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )| A. | t1时,v正>v逆 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应停止 | D. | t2-t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i |
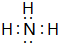 .
.
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子总数 | B. | 分子总数 | C. | 质量 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属镁工业冶炼的方法是采用直接加热分解法 | |
| B. | 石油是由多种碳氢化合物组成的混合物 | |
| C. | 煤的主要成分是碳单质 | |
| D. | 酸雨的形成主要是由于CO2含量过高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com