

 ;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O. 分析 (1)与-OH相连C上有2个H可催化氧化生成醛,与-OH相连C上只有1个H可催化氧化生成酮,与-OH相连C上没有H能不能发生催化氧化反应,以此来解答;
(2)连接卤原子或羟基碳原子相邻碳原子上含有氢原子的卤代烃或醇能发生消去反应,如果醇有两种β-H,消去产物只有两种;
(3)只含有一个α-H的醇被氧化成酮;所以能被氧化成酮的醇是 ;反应的化学方程式为:2CH3CH(OH)CH2CH3+O2$→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;反应的化学方程式为:2CH3CH(OH)CH2CH3+O2$→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
解答 解:(1)① 中与-OH相连C上只有1个H可催化氧化生成酮,故不选;
中与-OH相连C上只有1个H可催化氧化生成酮,故不选;
② 中与-OH相连C上有2个H可催化氧化生成醛,故选;
中与-OH相连C上有2个H可催化氧化生成醛,故选;
③ 中与-OH相连C上有2个H可催化氧化生成醛,故选;
中与-OH相连C上有2个H可催化氧化生成醛,故选;
④ 中与-OH相连C上没有H能不能发生催化氧化反应,故不选;
中与-OH相连C上没有H能不能发生催化氧化反应,故不选;
故答案为:②③;
(2) 有两种β-H,
有两种β-H, 、
、 和
和 只有一种β-H,所以消去产物有两种的是①,故答案为:①;
只有一种β-H,所以消去产物有两种的是①,故答案为:①;
(3)只含有一个α-H的醇被氧化成酮;所以能被氧化成酮的醇是 ;反应的化学方程式为:2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O,故答案为:
;反应的化学方程式为:2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O,故答案为: ;2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意醇的结构及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
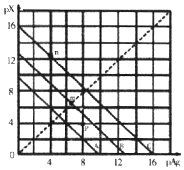 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | A线是AgCl的溶解平衡曲线 | |
| B. | 坐标点p形成的溶液是AgCl的不饱和溶液 | |
| C. | m点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | n点表示由过量的KI与AgNO3反应产生AgI沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烃的分子式为C7H8 | |
| B. | 该烃的含碳量大于乙烯的含碳量 | |
| C. | 该烃一氯代物有5种 | |
| D. | 该烃在光照或催化剂作用下能和氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应水化物能与其气态氢化物反应生成盐 |
| W | 原子的M电子层上有3个电子 |
| X | 在短周期元素中,其原子半径最大 |
| Y | 最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成Y的单质和H2O |
| Z | 元素最高正价与最低负价的代数和为6 |
| A. | M、Y、Z的简单离子半径依次增大 | |
| B. | W与Z形成的化合物属于离子化合物,其水溶液显酸性 | |
| C. | 化合物X2Y2、Y2Z2的晶体类型相同,化学键类型也相同 | |
| D. | M、W、X的最高价氧化物对应水化物两两之间能相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m、n | B. | 3、7 | C. | m-2、10-n | D. | m+2、n+10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
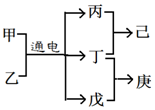 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期,甲、乙、己是由这些元素组成的二元化合物,0.001mol•L-1的己溶液pH为3,庚是具有漂白性的混合物,上述物质的转化关系如图所示,下列说法正确的是( )| A. | 原子半径Z>Y>X | |
| B. | 仅由这四种元素构成的溶液可能呈酸性、碱性或中性 | |
| C. | 己为由极性键构成的非极性分子 | |
| D. | 戊为一元弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com