
某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取8.16mL稀盐酸
B.用托盘天平称取25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL碱式滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年山西省高二12月月考化学试卷(解析版) 题型:简答题
(10分)工业制备氯化铜时,将浓盐酸用蒸气加热到80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去?______,理由是______________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___________(填序号);
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?__________,理由是___________________________。
③现有下列几种常用的氧化剂,可用于除去该混合溶液中Fe2+的有_________(填序号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2
除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有__________(填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
材料与化学密切相关。下列物质与材料对应关系不正确的是
A.晶体硅——光导纤维 B.氧化铝——耐火材料
C.铁碳合金——碳素钢 D.硅酸盐——普通玻璃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期第三次月考化学试卷(解析版) 题型:选择题
镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是
A.镁条作负极,电极反应:Mg-2e-=Mg2+
B.铝片作负极,电极反应:Al+4OH--3e--=AlO2-+2H2O
C.电流从Al电极沿导线流向Mg电极
D.铝片上有气泡产生
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期第三次月考化学试卷(解析版) 题型:选择题
已知反应A2(g)+2B2(g)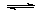 2AB2(g)的ΔH<0,下列说法正确的是
2AB2(g)的ΔH<0,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第一学期期末练习化学试卷(解析版) 题型:填空题
(14分)以煤为主要原料可以制备乙二醇,相关工艺流程如下:
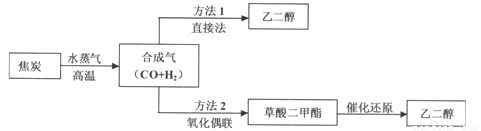
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是 (填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为 。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)  HOCH2CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备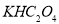 (草酸氢钾),
(草酸氢钾),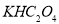 溶液呈酸性,用化学平衡原理解释: 。
溶液呈酸性,用化学平衡原理解释: 。
②在一定的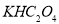 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是 (填字母)。
A.
B.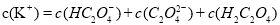
C.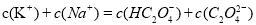
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的 (填“正”或“负”)级,负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第一学期期末练习化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,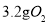 所含的原子数为0.2NA
所含的原子数为0.2NA
B.常温下11.2L甲烷气体所含的分子数为0.5NA
C.18gD2O所含的电子数为10NA
D.1.5molNO2与足量水反应,转移的电子数为1.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:选择题
在25℃时将两个铂电极插入一定质量的Na2SO4饱和溶液中进行电解。通电一段时间后,阴极上逸出 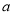 mol气体,同时有wgNa2SO4·10H2O晶体析出。若温度不变,则剩余溶液中溶质的质量分数为
mol气体,同时有wgNa2SO4·10H2O晶体析出。若温度不变,则剩余溶液中溶质的质量分数为
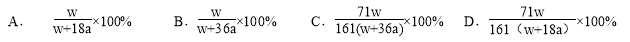
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高一上学期期末考试化学试卷(解析版) 题型:计算题
附加:(10分)(1)把一定质量的镁、铝混合物投入到1mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
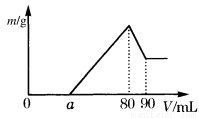
①金属铝的质量为________ g
②a的取值范围是________ mL。
(2)浓度分别为1mol /L的硫酸、氢氧化钠溶液各200mL分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为8:9,则甲、乙两烧杯中加入的铝的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com