

| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、溶液是电中性的,胶体是带电的 |
| B、两者的分散质微粒均能透过半透膜和滤纸 |
| C、溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D、一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.查看答案和解析>>
科目:高中化学 来源: 题型:
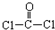 ,每个COCl2分子内含有
,每个COCl2分子内含有
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其它分散系的本质特征是具有丁达尔现象 |
| B、根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 |
| C、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
| D、胶体能透过半透膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com