


科目:高中化学 来源: 题型:
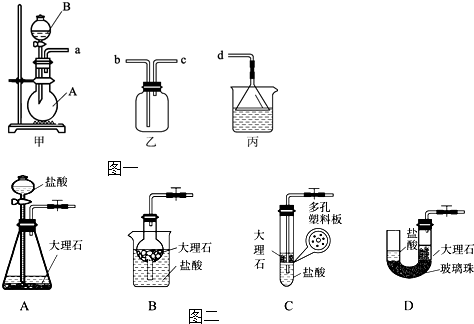
 卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.| c(WI2) |
| c(W)?c(I2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | ||
| V | Y | ||
| U | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
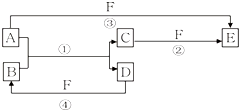 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中A、D是中学化学中常见的单质.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中A、D是中学化学中常见的单质.查看答案和解析>>
科目:高中化学 来源: 题型:
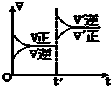 对达到平衡状态的可逆反应:X+Y?W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是( )
对达到平衡状态的可逆反应:X+Y?W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是( )| A、X、Y、W为气体,Z不是气体 |
| B、X、Y为气体,W、Z中有一种是气体 |
| C、W、Z为气体,X、Y中有一种是气体 |
| D、W、Z中有一种为气体,X、Y都不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在
| ||
| B、由水电离出的c(H+)和c(OH-)浓度的乘积为10-22的溶液H+、K+、ClO-、SO42- | ||
| C、在pH=7的溶液中,Fe3+、K+、Cl-、SO32- | ||
| D、甲基橙显红色的溶液中,Na+、K+、Cl-、S2O32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com