
反应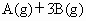
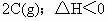 达平衡后,将气体混合物的温度降低,下列叙述正确的是
达平衡后,将气体混合物的温度降低,下列叙述正确的是
[ ]
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| c2(Z) |
| c(X)?c3(Y) |
| c2(Z) |
| c(X)?c3(Y) |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
反应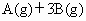
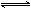
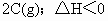 达平衡后,将气体混合物的温度降低,下列叙述正确的是
达平衡后,将气体混合物的温度降低,下列叙述正确的是
[ ]
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com