
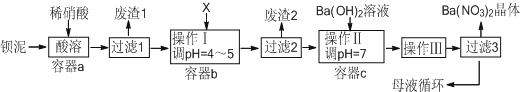
分析 钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,以此解答该题.
解答 解:(1)将BaCO3加入足量的饱和Na2CO3溶液中,存在BaSO4(s)?Ba2+(aq)+SO42-(aq),钡离子与碳酸根离子结合生成碳酸钡沉淀,使硫酸钡的沉淀溶解平衡正移,从而转化为碳酸钡,其反应的离子方程式为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),
故答案为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,
故答案为:B;
(4)已知Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7,流程中调节pH为4~5,所以三价铁离子会完全转化为沉淀Fe(OH)3,
故答案为:Fe(OH)3;
(5)从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,然后过滤,所以操作Ⅲ为蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩、冷却结晶;
(6)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,
故答案为:c;
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x m
则 $\frac{261}{x}$=$\frac{233}{m}$,解得x=$\frac{261m}{233}$,所以该Ba(NO3)2的纯度为$\frac{\frac{261m}{233}}{w}$×100%=$\frac{261m}{233w}$×100%,
故答案为:$\frac{261m}{233w}$×100%.
点评 本题考查物质的制备,为高考常见题型,侧重考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ | D. | $\frac{c({H}^{+})}{c(HF)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>a>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
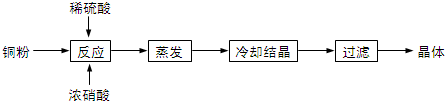
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
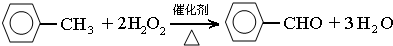
 苯甲醛(
苯甲醛(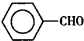 )、苯甲酸(
)、苯甲酸(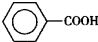 )都是重要的化工原料,都可用甲苯(
)都是重要的化工原料,都可用甲苯( )为原料生产.下表列出了有关物质的部分物理性质,请回答:
)为原料生产.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 ρ水=1g/cm3 | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com