
【题目】有一种化合物结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y是同周期元素,Z的含氧酸均具有氧化性,该化合物相对分子质量小于125。下列有关说法正确的是
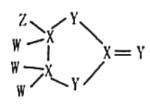
A.WZ沸点高于W2Y的沸点
B.X的含氧酸一定为二元弱酸
C.原子半径大小:Z>Y>X>W
D.X与Z组成的化合物中可能含有非极性键
【答案】D
【解析】
根据该物质中各元素的成键特点可知W、Z为H、F或Cl中两种,因W在四种元素中原子序数最小,则W不可能是Cl,为H或F;X、Y同周期,X应为第ⅣA族元素,Y应为第ⅥA族元素,若X、Y分别为Si和S,则Z为Cl,此时该物质的相对分子量至少为28×3+32×3+35.5>125,故不符合题意,所以X为C,Y为O,则W只能为H,又因为Z的含氧酸均具有酸性,所以Z为Cl。
A.H2O分子间存在氢键,导致其沸点较高,即沸点:HCl<H2O,故A错误;
B.C可以形成无机酸碳酸,也可以形成有机一元酸,如甲酸、乙酸等,所以X的含氧酸不一定为二元弱酸,故B错误;
C.同一周期从左向右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,则原子半径大小:Z>X>Y>W,故C错误;
D.C与Cl形成的化合物中含有多个C原子时,其中含有的C-C键为非极性键,故D正确;
故选:D。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示不正确的是
A.葡萄糖的最简式:CH2O
B.次氯酸的结构式:H-O-Cl
C. 可以表示32S2- ,也可以表示34S2-
可以表示32S2- ,也可以表示34S2-
D.![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L容器中发生反应,A、B、C物质的量随时间变化的曲线如图所示。下列叙述中正确的是
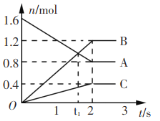
A.该反应的化学方程式为2A![]() B+3C
B+3C
B.反应开始至2s时,A的平均反应速率为0.4 mol(/L·s)
C.t1时刻,该反应达到化学平衡状态
D.反应开始至1s时,生成C的物质的量大于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含![]() 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
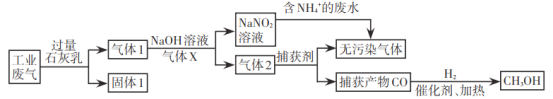
已知:1 mol CO和1 mol CH3OH分别完全燃烧生成CO2(g)和H2O(l),放出的热量为283.0kJ和726.5kJ。下列说法错误的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.气体X在流程中体现还原性
C.相同质量的CO和CH3OH完全燃烧,后者放出的热量多
D.处理含![]() 废水时,发生反应的离子方程式为:
废水时,发生反应的离子方程式为:![]() +
+![]() =N2↑+2H2O
=N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程。
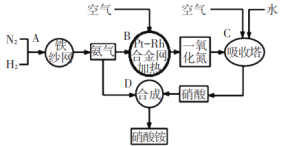
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:_____。
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为![]() ,此时H2的转化率为_____。
,此时H2的转化率为_____。
(3)设备B中反应的化学方程式为____。
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取_____吨硝酸铵。
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:

该装置的负极为_____(填a或b),试写出a极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为研究SO2的化学性质并探究与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持,加热装置已略,气密性已检验)
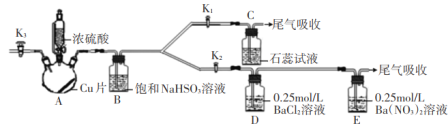
实验操作和现象如下:
(1)关闭活塞K2,K3,打开活塞K1,向A中滴加一定量的浓硫酸并加热,A中有白雾生成,铜片表面产生气泡。
(2)当C出现明显现象后,关闭K1,并停止加热。
①写出A中发生反应的化学反应方程式______;
②B装置的作用是_____;
③C中的现象为__;
(3)打开活塞K2,再向A中滴加一定量的浓硫酸并加热,D中有气泡冒出,产生少量白色沉淀,E中产生白色沉淀,液面上方略显浅棕色并逐渐消失;
(4)从D、E中分别取少量白色沉淀,加稀盐酸,白色沉淀不溶解。
①分析D中产生不溶于稀盐酸的沉淀的原因____;
②为了证实上述分析是否正确,在原实验基础上,在打开活塞K2之后增加一步操作,该操作是___;
(5)增加以上操作后,重复实验步骤(3),D中无沉淀生成,而E中仍产生白色沉淀,用离子方程式解释E中仍有白色沉淀的原因__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃的说法错误的是( )
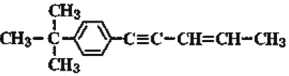
A.该烃分子中共面的碳原子最多为 14 个
B.该烃分子中共直线的碳原子最多为 6 个
C.该烃存在顺反异构
D.该物质可以发生氧化反应、取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用软锰矿浆(主要成分是MnO2)吸收工业废气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外,还含有少量Fe2+、Al3+、Ca2+等金属离子):
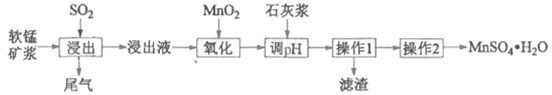
“操作1”的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
(1)浸出过程中被氧化的物质的化学式为____________。
(2)氧化过程中主要反应的离子方程式为_____________
(3)在氧化后的液体中加入石灰浆调节pH, pH 的范围是__________。
(4)操作2包括蒸发浓缩、__________、 过滤、 洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720 g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200 mL溶液。取20.00 mL该溶液,向其中逐滴加入0.0500 mol·L-1的FeSO4溶液,发生如下反应: Fe2+ +Mn3+=== Fe3+ + Mn2+当反应恰好完全进行时,共消耗FeSO4溶液19.50 mL。计算MnSO4·H2O的纯度(写出计算过程,结果保留四位有效数字)__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分Fe3O4,Fe2O3,FeO和部分难溶于酸的杂质)制备绿矾(FeSO47H2O)的流程如下:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为____________(填名称)。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、____________。
(3)检验②中Fe3+已经完全转化为Fe2+实验方法:取适量溶液2,____________。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、____________、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com