
分析 (1)①蛋白质为氨基酸的缩聚产物;
②葡萄糖在人体内氧化释放能量;
(2)缺碘易患地方性甲状腺肿;
(3)为防止贫血,常在酱油中补充铁;
(4)蛋白质灼烧时具有烧焦羽毛的气味.
解答 解:(1)①蛋白质为氨基酸的缩聚产物,水解的最终产物为氨基酸,故答案为:B;
②葡萄糖在人体内氧化释放能量,为人体内最重要的供能物质,故答案为:A;
(2)缺碘易患地方性甲状腺肿,故答案为:C;
(3)为防止贫血,常在酱油中补充铁,故答案为:酱油;
(4)蛋白质灼烧时具有烧焦羽毛的气味,为蛋白质的特性,故答案为:烧焦羽毛.
点评 本题考查知识点较多,侧重于化学与生活的考查,有利于培养学生的良好的科学素养,注重化学与生活的联系,熟悉常见的药物的作用,利用化学知识来解决生活中的问题即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
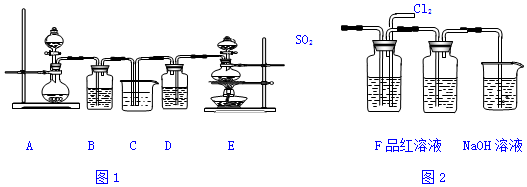
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
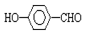
 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:| 容器编号 | 温度/℃ | 容器体积/L | Cl02(g)的平衡转化率 |
| a | T1 | V1=l L | 75% |
| b | T1 | v2 | |
| c | T3 | v3 | 75% |
| d | |||
| e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与其他分散系最本质的区别是分散质粒子的直径介于1-100 nm之间 | |
| B. | 胶体和溶液都一定是均一透明的分散系,可以用丁达尔效应来鉴别 | |
| C. | 制备Fe(OH)3胶体的操作为,在沸水中逐滴滴加5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热 | |
| D. | 用过滤的方法可以将胶体和溶液分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气为纯净物 | |
| B. | 天然气是不可再生的能源 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 过量的CH4和Cl2在光照条件下反应只生成CH3Cl和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
 的沸点比
的沸点比 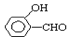 高,原因是:
高,原因是: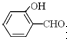 形成分子内氢键,而
形成分子内氢键,而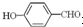 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子分离膜应用于食品工业中,可用于浓缩天然果汁、乳制品加工、酿酒业等 | |
| B. | 合成高分子材料制成的人工器官一般都受到人体的排斥作用,难以达到生物相容的程度 | |
| C. | 复合材料一般是以一种材料作为基体,另一种材料作为增强剂 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com