
【题目】香叶醇是合成玫瑰香油的主要原料,其结构简式如图:下列有关香叶醉的叙述正确的是( )

A. 香叶醇的分子式为C10H18O
B. 不能使溴的四氯化碳溶液褪色
C. 不能使酸性高锰酸钾溶液褪色
D. 能发生加成反应不能发生取代反应
科目:高中化学 来源: 题型:
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:____________________
(2)配平该方程式____FeC2O4·H2O+___H2O+ __K2 C2O4+__H 2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式______;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:![]() 。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
(1)下列情况下,反应达到平衡状态的是_____(填序号)
A、3molH-H共价键断裂同时有6molN-H共价键形成
B、3v正(N2)=v逆(H2)
C、混合气体的平均相对分子质量保持不变
(2)反应的平衡常数K=_____________________(结果保留3位有效数字).
(3)分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Pt-g-C3N4为催化剂,用光催化氧化法脱除NO的过程如图所示。
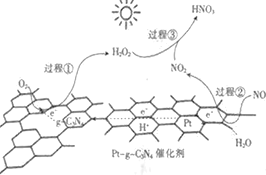
该脱除过程中,下列说法不正确的是
A. 该过程为太阳能转化为化学能
B. Pt端发生的是氧化反应
C. 过程①发生的电极反应为H2O2-2e-=O2↑+2H+
D. 过生③的化学方程式为2NO2+H2O2=2HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷可通过下列反应生成:
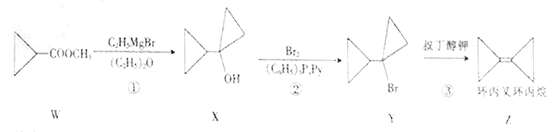
下列说法不正确的是
A. 反应②属于取代反应
B. Z与苯互为同分异构体
C. Z分子中所有碳原子处于同一平面
D. 与W互为同分异构体的链状羧酸类化合物有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和NaAlO2混合溶液中滴加NaHCO3溶液,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积的变化情况如图所示。下列说法不正确的是
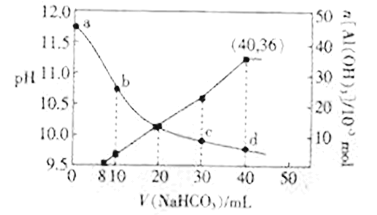
A. 加入的NaHCO3先与NaOH反应
B. b点和c点均有c(Na+)<2c(CO32-)+c(HCO3-)
C. NaHCO3溶液的物质的量浓度为1.125 mol·L-1
D. d点时:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛的合金及其化合物用途非常广泛,回答下列问题:
(1)Al65Cu20Co15是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___方法区分晶体、准晶体和非晶体。
(2)基态Al原子价电子排布式为____,铝的第一电离能比镁的低,是因为____。
(3)AlF3的熔点(1040℃)比AlCl3(194℃)高得多,这是因为____;气态时,氯化铝以双聚体的形式存在,画出Al2Cl6的结构:____。
(4)TiO2+检验反应为TiO2++H2O2=[TiO(H2O2)]2+(橙红色),配离子[TiO(H2O2)]2+中与中心原子形成配位键的原子是__;H2O2中氧原子的杂化方式是___,H2O2的沸点(158℃)比键合方式相同的S2Cl2(138℃)的高,其原因是____。
(5)铝钛合金可用作磁控溅射镀膜的原材料,它的晶体结构及晶胞参数如图所示(Ti、Al位于面心或顶点)。阿伏加德罗常数的值为NA,则该铝钛合金的密度为__g·cm-3(列出表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B.铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化铁胶体的制备:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com