
����Ŀ��80 ��ʱ��2 L �ܱ������г���0.40 mol N2O4��������ӦN2O4![]() 2NO2 ��H����Q kJ��mol-1��Q��0���������������:�����ж���ȷ����
2NO2 ��H����Q kJ��mol-1��Q��0���������������:�����ж���ȷ����
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol��L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. �����¶ȸ÷�Ӧ��ƽ�ⳣ��K��С
B. 20��40 s �ڣ�v��N2O4����0.002 mol/L .s
C. ��Ӧ��ƽ��ʱ�����յ�����Ϊ0.30 Q kJ/mol
D. 100s ʱ��ͨ��0.40 mol N2O4������ƽ��ʱN2O4��ת���ʼ�С
���𰸡�D
��������A���˷�Ӧ�����ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�ƶ�����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�������¶ȣ�K����A����B��20��40sʱ������N2O4��Ũ��Ϊ(0.2��0.12)/2mol��L��1=0.04mol��L��1�����ݻ�ѧ��Ӧ���ʱ���ʽ����v(N2O4)=0.04/10mol/(L��s)=0.004 mol/(L��s)����B����C������2molNO2ʱ������������QkJ������0.3��2molNO2�����յ�������0.6Q/2kJ=03QkJ����C����D����ͨ��N2O4��ƽ����Ȼ������Ӧ�����ƶ�����N2O4��������ת���ʽ��ͣ���D��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ��ͬѹ�£�A�����е�������O2����B�����еİ�����NH3��������ԭ�Ӹ�����ͬ����A��B����������������֮������ ��
A��1��2 B��2��1 C��1��1 D�����Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�����ͼ��ķ����������
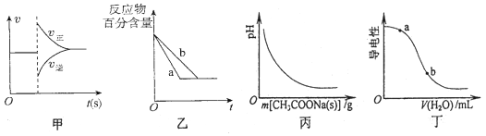
A��ͼ�ɱ�ʾ��ƽ��N2(g)+3H2(g)![]() 2NH3(g)��ѹ��ͬʱ�Ƴ�����NH3ʱ�����ʱ仯
2NH3(g)��ѹ��ͬʱ�Ƴ�����NH3ʱ�����ʱ仯
B��ͼ����a��b�����ɱ�ʾ��ӦH2(g)ʮI2(g)![]() 2HI(g)���д��������������½���ƽ��Ĺ���
2HI(g)���д��������������½���ƽ��Ĺ���
C��ͼ����ʾ��CH3COOH��Һ������CH3COONa�������ҺpH�ı仯
D��ͼ����ʾ�������Һ�м�ˮʱ�䵼���Ա仯����CH3COOH��Һ��pH��a<b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£�ˮ��Һ��c(H+)��c(OH��)����ͼ��ʾ��ϵ�����������������ӹ���˵������ȷ����

A. a���Ӧ����ɫ��Һ���ܴ������ڣ�Fe3+��Na+��Cl-��SO42-
B. b���Ӧ����Һ���ܴ������ڣ�NH4+��Ca2+��AlO2-��I-
C. c���Ӧ����Һ���ܴ������ڣ�Na+��Ba2+��Cl-��CO32-
D. d���Ӧ����Һ���ܴ������ڣ�Na+��K+��SO32-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ϢϢ��ء����������������
A. �Ŵ�����������Һ���������ͭ�������ͭ��
B. Ba2+������������BaSO4��ҽѧ�Ͽ���������
C. �����Ƽ��ҵ������Ӧ���������ܽ�ȵIJ���
D. ��ú���������� ú�ĵ硱�ȹ��������ڼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǻ�ѧʵ������Ҫ����ɲ��֡�
���к��ȵIJⶨ��
��1����ʵ�����У���50 mL 0.40 mol/L��������50 mL 0.50mol/L��NaOH��Һ��Ӧ�ⶨ���ȡ������ʱ��Һ�ܶȾ�Ϊ1 g/cm3��������Һ�ı�����c = 4.18 J/(g��)��ʵ����ʼ�¶�ΪT1�棬��ֹ�¶�ΪT2�棬��д���к��ȵļ���ʽ(д�������)��H=__________KJ/mol��
��2��1L1mol/LH2SO4��Һ��2L1mol/LNaOH��Һ��ȫ��Ӧ���ų�114.6 kJ����������д����ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽ ��
����������ԭ�ζ�ʵ�����к͵ζ����ơ�Ϊ�ⶨijH2C2O4��Һ��Ũ����ȡ����Һ����ƿ������������ϡH2SO4������Ũ��Ϊc mol/L KMnO4����Һ�ζ���
��1���ζ�ԭ��Ϊ�� (�����ӷ���ʽ��ʾ)��
��2���ζ�ʱ��KMnO4��ҺӦװ�� (���ʽ����ʽ��)�ζ����У��ﵽ�ζ��յ�ʱ����ɫ�仯Ϊ ��
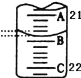
��3����ͼ��ʾ50mL�ζ�����Һ���λ�ã���ʱ�ζ�����Һ��Ķ���Ϊ mL��
��4��Ϊ�˼�Сʵ������ͬѧһ������������ʵ�飬����ÿ����ȡH2C2O4��Һ�����ΪVmL������ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����KMnO4��Һ���/mL | 26.32 | 24.02 | 23.98 |
���ϱ����Կ�������һ��ʵ���м�¼����KMnO4��Һ��������Զ��ں����Σ���ԭ������� ��
A��ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱKMnO4��Һ�����
B���μ�KMnO4��Һ���죬δ������տ�����Һ��ɫ������ֹͣ�ζ�
C����һ�εζ�ʢװ��Һ�ĵζ���װҺǰ������ˮ��ϴ����δ�ñ�Һ��ϴ�������ξ��ñ�Һ��ϴ
D����һ�εζ��õ���ƿ�ô�װҺ��ϴ����������δ��ϴ
��5��д������H2C2O4�����ʵ���Ũ�ȵ�������ʽ��C= mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ����
A. 0.2mol������������ϡ���ᷴӦ����������ķ���ЧĿΪ0.3NA
B. ���³�ѹ�£�14g��C2H4��C3H6��ɵĻ�������к���̼ԭ�ӵ���ĿΪNA
C. 2.24LCO2��������Na2O2��Ӧ��ת�Ƶĵ���������Ϊ0.1NA
D. 1L1mol/L��KAl(SO4)2��Һ������������Ϊ2NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com