
【题目】已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O下列说法中错误的是( )
2PbSO4+2H2O下列说法中错误的是( )

A.b电极放电后转化为c电极
B.电极a和d都发生还原反应
C.b的电极反应式:Pb+SO42﹣﹣2e-→PbSO4
D.放电后硫酸溶液的pH增大
科目:高中化学 来源: 题型:
【题目】向13.6g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.25 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入0.5 mol/L的NaOH溶液1 L,反应后溶液恰好呈中性,金属离子已完全沉淀,沉淀质量为19.6 g,下列说法不正确的是
A.Cu与Cu2O的物质的量之比为2∶1
B.硝酸的物质的量浓度为2 mol/L
C.Cu、Cu2O与硝酸反应后剩余HNO3的物质的量为0.5 mol
D.产生的NO在标准状况下的体积为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息筛选:
Ⅰ.某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
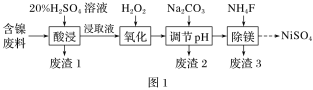
已知:①SiO2不溶于稀硫酸。
②Ksp(MgF2)=7.4×10-11。
③有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
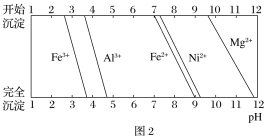
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是_______________(填化学式)。
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理加以解释:___(用必要的文字和离子方程式回答)。
(3)已知沉淀前溶液中c(Mg2+)=1.85×10-3 mol·L-1,当除镁率达到99%时,溶液中c(F-)=_________mol·L-1。
(4)在NaOH溶液中用NaClO与NiSO4反应可制得NiO(OH),化学方程式为______。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。实验室可通过滴定的方法测定所制硝酸银样品的纯度(杂质不参与反应),测定过程如下,已知:Ag++SCN-=AgSCN↓(白色)。
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100mL。溶液配制过程 中所用的玻璃仪器除烧杯、玻璃棒外还有_____________________________。
(2)准确量取25.00mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100mol·L-1NH4SCN标准溶液滴定。滴定终点的实验现象为__________。
(3)若滴定前滴定管尖嘴处有气泡,滴定过程中该气泡消失,则所测硝酸银的质量分数________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火。实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g(25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃)。
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为___g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
①求25℃时KCl的溶解度___;
②求原混合物中KClO3的质量___;
③所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为多少___?(保留2位小数)
(3)工业常利用3Cl2+6KOH(热)→KClO3+5KCl+3H2O,制取KClO3(混有KClO)。实验室模拟KClO3制备,在热的KOH溶液中通入一定量氯气充分反应后,测定溶液中n(K+):n(Cl-)=14:11,将所得溶液低温蒸干,那么在得到的固体中KClO3的质量分数的取值范围为多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下某H2CO3溶液的pH约为5.5,c (CO32-)约为5×10-11 mol/L,该溶液中浓度最低的离子是
A.HCO3-B.CO32-C.H+D.OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第VIIA族元素的单质及其化合物的用途广泛.完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有___种不同能量的电子.
(2)能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号).
a.IBr中溴为﹣1价 b.HBr、HI的酸性c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)海水提溴过程中,先向浓缩海水中通入_____,将其中的Br﹣氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收.已知纯碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_____mol,反应中氧化产物为_____.
(4)已知:AlF3的熔点为1040℃,AlCl3在178℃升华.从物质结构的角度解释两者熔点相差较大的原因:__________
(5)HClO有很好的杀菌消毒效果.为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定某一元弱酸(已知其在该条件下的电离度α≈1%)的滴定曲线如图所示。横坐标为加入氢氧化钠的体积,纵坐标为溶液的pH。下列说法正确的是( )
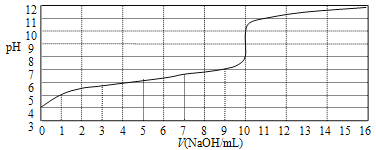
A.此一元弱酸的电离常数(Ka)约为1.0×10-6
B.此弱酸的浓度为1×10-4mol/L
C.此实验可选用甲基橙作指示剂
D.此实验可选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com