
| A. | 弱电解质一定是共价化合物 | |
| B. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明NH3•H2O电离处于平衡状态 | |
| C. | 强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 | |
| D. | 由0.1 mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH═B++OH- |
分析 A.弱电解质也不一定是共价化合物;
B.一水合氨为弱电解质,电离产生铵根离子与氢氧根离子速率与离子结合生成一水合氨的速率相等时达到平衡;
C.强电解质完全电离,弱电解质部分电离;
D.0.1 mol•L-1一元碱BOH的pH=10,说明BOH不能完全电离.
解答 解:A.弱电解质也不一定是共价化合物,如氢氧化铝是弱电解质,但它是离子化合物,故A错误;
B.一水合氨为弱电解质,电离产生铵根离子与氢氧根离子速率与离子结合生成一水合氨的速率相等时达到平衡,故B错误;
C.强电解质完全电离,溶液中不存在溶质分子,弱电解质部分电离,弱电解质溶液中存在溶质分子,故C正确;
D.0.1 mol•L-1一元碱BOH的pH=10,说明BOH不能完全电离,是弱电解质,则:BOH?B++OH-,故D错误;
故选;C.
点评 本题考查了电解质强弱的判断及性质,明确强、弱电解质概念及电离方式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
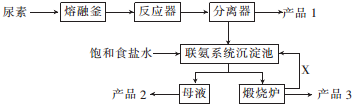
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
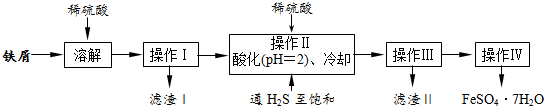
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③ | C. | ①③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存在水中 | B. | 密封,保存在广口瓶中 | ||
| C. | 用铝箔包裹,密封在广口瓶中 | D. | 密封,保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 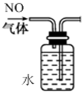 排水法收集NO | |
| B. | 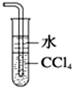 吸收尾气中少量NH3或HCl,并防止倒吸 | |
| C. |  制取并收集少量NH3 | |
| D. | 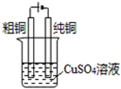 电解精炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K | B. | Ba2+、Ca2+、Mg2+ | C. | K+、Ca2+、Cl- | D. | N、O、F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com