
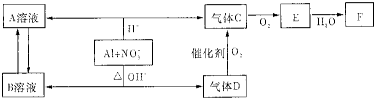
(14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:
其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是
(4)D—→C反应的化学方程式是
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
(16分,每小题2分)
(1) C
(2) AlO2— + NH3
(3) 3NH3·H2O +Al3+ == Al(OH)3↓+3 NH4+
(4) 4 NH3 +5O2 == 4NO + 6 H2O
(5) N2
(6) 3NO2 + H2O == 2HNO3 + NO
(7) 1:1
解析:当Al与稀硝酸反应时,稀硝酸表现的性质是强氧化性及酸性。Al + NO3-+ OH-+ H2O→AlO2—+NH3。过量氨水溶液与Al Cl3溶液反应的离子方程式是3NH3·H2O+Al3+ == Al(OH)3↓+3 NH4+。氨气的催化氧化方程式为4 NH3 +5O2 == 4NO + 6 H2O。除去NO中的NO2气体杂质可用的化学方法是3NO2 + H2O == 2HNO3 + NO。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省长沙市雅礼中学高三(上)月考化学试卷(9月份)(解析版) 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
化学方程式练习
一、用化学方程式表示下列各种物质的实验室制法
1、O2(三种方法):
2、H2:
3、Cl2:
4、NH3:
5、CO2:
6、NO:
二、用方程式表示工业生产过程(参考选修Ⅱ,带*的写离子方程式,注意反应条件)
1、氯碱工业(电解饱和食盐水)
*阳极:
*阴极:
*总反应:
2、接触法制硫酸(硫铁矿为原料)
①沸腾炉: ;其中氧化产物为:
②接触室: ;
V2O5的作用是 ,反应温度控制在400~500℃的原因是
③吸收塔:
用98%H2SO4吸收SO3而不用水直接吸收的原因是
。
④尾气处理:
3、海水提溴:
*①氯化:
②吹出
③吸收:
④转化:
4、合成氨:
①由水和碳合成H2
②合成塔:
5、氨氧化制硝酸
①氧化炉:
②吸收塔:
③制取化肥硝酸铵:
6、冶炼铝(冰晶石作熔剂)
①碱溶:
②沉淀:
③脱水:
④电解:*阳极:
*阴极:
总反应:
7、铝热法制铁
8、由三氧化钨制钨
9、工业制漂白粉
10、制玻璃
11、工业生产石灰浆
12、联合制碱法:
13、高纯硅的生产
。
14、炼铁炼钢
①还原剂的生成:
;
②铁的还原(将铁的氧化物,如Fe2O3还原):
③将生铁脱硫去磷降低含碳量即得钢。
三、完成下列反应的化学方程式(注意写反应条件)。
1、Fe + H2O(g)=
2、C+ H2O(g) =
3、CO+ H2O(g) =
4、F2+ H2O=
5、NH3+H2O
6、NO2+ H2O=
7、SO2+ H2O
8、Cl2 + H2O=
9、K + H2O=
10、Na2O2+ H2O=
11、CaC2+ H2O=
12、Mg3N2+ H2O =
13、Al + NaOH+ H2O=
14、CaCO3+ H2O+ CO2=
15、Fe(OH)2+ H2O+ O2=
16、FeCl3+ H2O
17、NH4Cl+H2O
18、Na2CO3+H2O
19、CuSO4+H2O电解
20、Na2S2O3 + HCl =
21、SiO2 + HF=
22、SiO2 + NaOH=
23、Na2SiO3+ HCl=
四、写出下列物质分别与NaOH溶液反应的化学方程式。
1、Si
2、Cl2
3、SiO2
4、SO2 (足量)
5、CO2(小量)
6、H3PO4
7、H2SO4
8、CH3Br
9、Al
10、Al2O3
11、AlCl3
12、Al(OH)3
13、CuSO4
14、NaHCO3
15、Ca(HCO3)2(足量)
16、(NH4)2SO4
五、写出下列物质受热或光照的化学方程式。
1、NaHCO3
2、HNO3
3、AgBr
4、H2SO3
5、NH4HCO3
6、Cu(OH)2
7、Ca(HCO3)2
8、Cu2(OH)2CO3
9、H2O2
10、KClO3
11、KMnO4
12、NH4Cl
13、HClO
14、CH4+Cl2
15、H2+Cl2
16、CuO
六、写出下列反应的化学方程式和离子方程式
1、SO2使溴水褪色:
2、SO2使酸性高锰酸钾溶液褪色:
3、氢氧化铁溶于氢碘酸:
4、乙二酸(草酸)使酸性高锰酸钾溶液褪色 :
5、用石灰水与小苏打溶液制烧碱:
6、硫酸氢铵与氢氧化钡溶液混合:
7、漂白粉溶液中充入足量CO2:
8、KHSO4与氢氧化钡溶液混合呈中性:
9、Fe3O4溶于稀硝酸:
10、明矾溶液中加Ba(OH)2溶液至沉淀量最大:
七、用离子方程式表示下列在溶液中的反应
1、KCl+AgNO3:
2、Ba(OH)2+H2SO4:
3、BaCO3+HCl:
4、Cu(OH)2+HCl:
5、Fe(OH)2+HNO3(稀) :
6、FeCl3+KSCN:
7、FeBr2+Cl2(物质的量之比为1:1):
8、NaBr+Cl2:
9、Fe+CuCl2:
10、Zn+AgNO3:
11、纯碱水解:
12、明矾净水:
13、铜和稀硝酸:
14、配制银氨溶液:
15、Na2O2投入稀硫酸中:
八、写出下列物质在空气中变质的化学方程式
1、Na2SO3:
2、NaOH:
3、NO:
4、Na:
5、Na2O2:
6、铜生锈:
7、氯水:
8、白磷:
9、稀硫酸酸化的FeSO4溶液变棕黄色
10、无色KI溶液变棕黄色
11、漂白粉失效:
九、写出下列反应的化学方程式
1、混合H2S和SO2生成硫和水:
2、炭加热放入浓硫酸中:
3、乙醇催化氧化为乙醛:
4、乙醛与银氨溶液反应:
5、乙醛与新制Cu(OH)2加热:
6、铜与浓硫酸共热:
7、氧化硫通入浓溴水:
8、铜与浓硝酸反应:
9、木炭和浓硝酸共热:
10、FeCl3溶液中加入KI溶液:
11、高锰酸钾固体中滴入浓盐酸:
12、氨水通入少量SO2:
13、偏铝酸钠溶液中加足量稀硫酸:
14、NaAlO2溶液中充入足量CO2:
15、Ba(AlO2)2溶液中加入硫酸铝溶液:
16、氢氧化亚铁水溶液在空气中变质:
12、氯化铁溶液溶解铜:
十、按要求写方程式
1、写出高温条件下发生的置换反应四个:
①
②
③
④
2、写出一个点燃条件下的置换反应:
3、写出一个加热条件下的置换反应:
4、写出一个有三种反应物的置换反应:
5、写出工业生产中需要高温条件的反应(不少于5个)的化学方程式:
6、试设计一个实验,检验某溶液中存在Fe2+,请在下面的横线上按操作顺序写出相应的离子方程式: 。
7、治疗胃酸过多的药物中常用Al(OH)3,如何用氧化铝制取氢氧化铝?要求制取过程中酸碱的用量降到最少。按生产顺序写出相关的离子方程式: 。
8、化学反应中有的具有相似性,有的反应具有特殊性,试写出下列相关化学方程式,并思考其中的原因:
① Li + O2
Na + O2
② Mg + CO2
Mg + SO2
③ Na2O2 + CO2
Na2O2 + SO2
KO2 + CO2
④ F2 + H2O
Cl2 + H2O
⑤ Fe + Cl2
Fe + I2
⑥ Fe(OH)3 + HCl
Fe(OH)3 + HI
9、按要求写化学方程式
①碱性氧化物与水反应(举2例)
②碱性氧化物与酸反应(举2例)
③金属氧化物但不是碱性氧化物的氧化物与水反应(举一例)
④酸性氧化物与水反应(举2例,其中一例为金属氧化物)
⑤能与水反应生成酸,但不是酸性氧化物也不是碱性氧化物氧化物与水反应的化学方程式:
。
⑥列举不少于5类既能与强酸反应,又能与强碱反应的物质,并分别写出它们与酸(HCl)、碱(NaOH)反应的离子方程式:
A、物质化学式:
B、物质化学式:
C、物质化学式:
D、物质化学式:
E、物质化学式:
F、物质化学式:
G、物质化学式:
10、某酸性氧化物,它能与某些酸反应,也能与碱反应,请写出这样的氧化物一种,并写出它与酸反应的化学方程式和与碱反应的离子方程式:
氧化物分子式:
查看答案和解析>>
科目:高中化学 来源:2012学年山东省潍坊市高二寒假作业化学试卷(四) 题型:单选题
下面提到的问题中,与盐的水解有关的正确说法是
①明矾和FeCl3可作净水剂.利用铝离子水解形成胶体,利用胶体的强吸附性净水;
②为保存FeCl3溶液,要在溶液中加少量盐酸,抑制三价铁离子水解.
③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释,抑制铝离子水解.
④NH4Cl与ZnCl2溶液可作焊接中的除锈剂,是因为铵根水解,溶液显酸性.
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞,碳酸根水解,溶液显碱性缘故.
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂,是利用铝离子和碳酸氢根双水解,产生氢氧化铝和二氧化碳.
⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气,是因为铵根水解,溶液显酸性.
⑧长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用,铵根和碳酸根双水解,产生氨气,肥效消失.
⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性,考虑铵根水解,硫离子水解.
| A.①④⑦ | B.②⑤⑧ | C.③⑥⑨ | D.全有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com