
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.分析 (1)32.0g N2H4的物质的量=$\frac{32g}{32g/mol}$=1mol,1mol联氨和双氧水反应生成氮气和液体水放出热量642kJ,据此书写热化学反应方程式;
(2)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,正极上是氧气得到电子生成氢氧根离子;
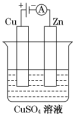
(3)①装置为电解池,锌和电源负极相连为电解池的阴极,溶液中铜离子得到电子生成铜;
②根据电极反应,结合电子守恒和空气的组成情况来回答;
(4)NaClO氧化NH3可以制得肼,还生成氯化钠.
解答 解:(1)32.0g N2H4的物质的量=$\frac{32g}{32g/mol}$=1mol,1mol联氨和双氧水反应生成氮气和液态水放出热量642kJ,其热化学反应方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol;
(2)肼-氧气碱性燃料电池中,正极上氧气得到电子法还原反应生成氢氧根离子,电极反应为:O2+2H2O+4e-═4OH-,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,
故答案为:O2+2H2O+4e-═4OH-; N2H4+4OH--4e-═4H2O+N2↑
(3)①装置为电解池,锌和电源负极相连为电解池的阴极,溶液中铜离子得到电子生成铜,电极反应为:Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
②铜片上的电极反应为:Cu-2e-=Cu,Cu的质量变化128g,根据电极反应,转移电子为4mol,根据反应N2H4+O2=N2+2H2O,当转移电子4mol时,消耗氧气的物质的量是1mol,氧气的体积是空气体积的五分之一,所以消耗空气的体积是5mol,即112L,
故答案为:112;
(4)NaClO氧化NH3可以制得肼的离子方程式为:ClO-+2NH3=N2H4+Cl-+H2O,
故答案为:ClO-+2NH3=N2H4+Cl-+H2O.
点评 本题是一道有关热化学和电化学知识的综合考察知识题目,要求学生具有分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Y<Z<X | B. | X<Y<Z | C. | Z<Y<X | D. | Y<X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑥ | C. | ②④⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | pH=5的NH4Cl溶液与pH=5的硫酸中,水电离的c(H+)相同 | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | pH=9的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:25 | B. | 1:55 | C. | 1:5 | D. | 1:100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com