
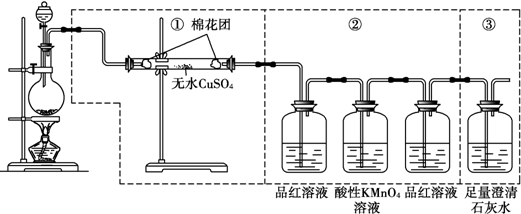
分析 (1)用无水硫酸铜来检验水的生成,用品红检验二氧化硫的生成,用澄清石灰水检验二氧化碳的生成,但是二氧化碳检验之前需要先把二氧化硫除净;(2)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,据此写出反应的化学方程式;
(3)②第一个品红溶液检验二氧化硫的生成,酸性KMnO4溶液除去二氧化硫,再用品红检验二氧化硫是否除尽;
(4)检验二氧化碳气体时必须排除二氧化硫的干扰,即:②中第二个品红溶液不褪色,然后再根据③中澄清石灰水是否变浑浊判断.
解答 解:(1)装置①为无水硫酸铜可以检验水的存在,②品红检验二氧化硫的生成,酸性KMnO4溶液除去二氧化硫,再用品红检验二氧化硫是否除尽,所以②可以检验并除去二氧化硫,③可以检验二氧化碳的存在,故答案为:H2O;SO2;CO2;
(2)碳可以和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)因为二氧化碳检验之前需要先把二氧化硫除净,所以②中第一个品红溶液检验二氧化硫的生成,酸性KMnO4溶液除去二氧化硫,再用品红检验二氧化硫是否除尽;故答案为:检验SO2气体的存在;检验SO2是否除尽;氧化除去SO2气体;
(4)二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,当②中第二个品红溶液不褪色,证明二氧化硫已经除尽,若③中澄清石灰水变浑浊,则证明混合气体中存在二氧化碳气体,
故答案为:②中第二个品红溶液不褪色,③中澄清石灰水变浑浊.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握C与浓硫酸反应的原理,明确常见气体的性质及检验方法,特别是气体检验的先后顺序.


科目:高中化学 来源: 题型:解答题
 某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.
某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
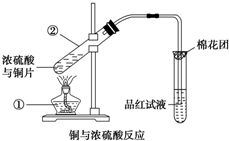 如图是铜与浓硫酸反应的实验装置图,请回答下列问题.
如图是铜与浓硫酸反应的实验装置图,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可以提高CO的转化率 | |
| B. | 加入催化剂能提高CO的转化率 | |
| C. | 缩小反应器容积可以使平衡正向移动 | |
| D. | 再充入适量H2,该反应平衡常数的数值会增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com