
�����£�ȡ0.1 mol/L��HA��Һ��0.1 mol/L��NaOH��Һ��������(��Ϻ���Һ����ı仯����)����û����Һ��pH��8���Իش��������⣺
(1)��Ϻ���Һ��pH��8��ԭ����________(�����ӷ���ʽ��ʾ)��
(2)��Ϻ����Һ����ˮ�������c(OH��)________0.1 mol/L��NaOH��Һ����ˮ�������c(OH��)(�����������������)��
(3)��֪NH4A��ҺΪ���ԣ���֪��HA��Һ�ӵ�NaHCO3��Һ��������ų������ƶ�NH4HCO3��Һ��pH________7(�����������������)��
(4)����ͬ�¶�����ͬŨ�ȵ���������Һ��
A��NH4HCO3��
B��NH4A��
C��(NH4)2SO4��
D��NH4Cl����pH�ɴ�С��˳������________(�����)��
 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
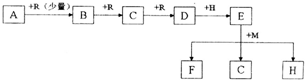
| ||
| ||

| ||
| ||
| 20V |
| 7 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
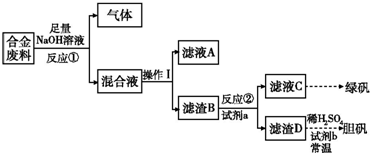
| ʵ���� | 1 | 2 | 3 | 4 |
| ϡHNO3�����mL�� | 100 | 200 | 300 | 400 |
| ʣ�����������g�� | 9.0 | 4.8 | 0 | 0 |
| NO�����L�� | 1.12 | 2.24 | 3.36 | V |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��8�֣���ѧѧ���е�ƽ��������Ҫ���ݰ�������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ������֡��Ҿ�������������ԭ������ش��������⡣
(1)һ���¶��£���һ���̶��ݻ����ܱ������У����淴Ӧ
A(g)+2B(g)![]() 4C(g)
4C(g) H��0 �ﵽƽ��ʱ��c(A)=2mol/L,c(B)=7mol/L, c(C)=4mol/L����ȷ��B����ʼŨ��c(B)��ȡֵ��Χ�� �����ı��������´ﵽƽ�����ϵ��C����������������д�ʩ���е���
������C�����ʵ��� �ڼ� ѹ ������ ��ʹ�ô���
(2)�����£�ȡpH=2������ʹ�����Һ��100mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ��� ���A����B�������������м����Zn����Ϊm1�� ������Һ�м����Zn����Ϊm2����m1 m 2��ѡ���������=������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ɽ���������и߶���ѧ��ѧ���϶����Ի�ѧ�������Ծ� ���ͣ������
��8�֣���ѧѧ���е�ƽ��������Ҫ���ݰ�������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ������֡��Ҿ�������������ԭ������ش��������⡣
(1)һ���¶��£���һ���̶��ݻ����ܱ������У����淴Ӧ
A(g)+2B(g)
 4C(g)
4C(g)  H
��0 �ﵽƽ��ʱ��c(A)=2mol/L,
c(B)=7mol/L, c(C)=4mol/L����ȷ��B����ʼŨ��c(B)��ȡֵ��Χ��
�����ı��������´ﵽƽ�����ϵ��C����������������д�ʩ���е���
H
��0 �ﵽƽ��ʱ��c(A)=2mol/L,
c(B)=7mol/L, c(C)=4mol/L����ȷ��B����ʼŨ��c(B)��ȡֵ��Χ��
�����ı��������´ﵽƽ�����ϵ��C����������������д�ʩ���е���
������C�����ʵ��� �ڼ� ѹ ���� �� ��ʹ�ô���
(2)�����£�ȡpH=2������ʹ�����Һ��100mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯 ��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ��� ���A����B�������������м����Zn����Ϊm1�� ������Һ�м����Zn����Ϊm2����m1 m 2��ѡ���������=������������
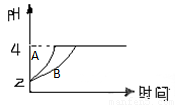
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com