
| 1000ρω |
| M |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
| n |
| V |
| n |
| V |
| n |
| v |
| n |
| v |


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| A、v(A)=0.5mol/(L?s ) |
| B、v(C)=6.0mol/(L?min) |
| C、v(B)=0.6mol/(L?s) |
| D、v(D)=0.4mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
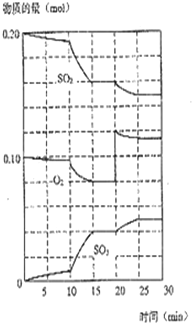 在一定条件下,二氧化硫和氧气发生如下反应:
在一定条件下,二氧化硫和氧气发生如下反应:| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
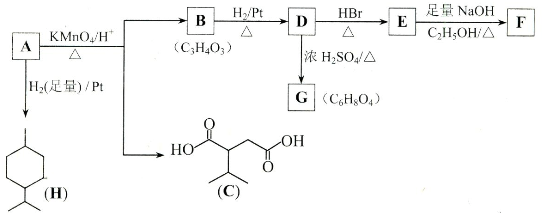
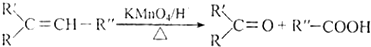
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 I、将锌片浸在硫酸铜中,用一根细铜棒抵住锌片的中部,发现铜棒变粗了,一段时间后,被铜棒抵住的部位出现了一个洞口.请你解释这两个现象:
I、将锌片浸在硫酸铜中,用一根细铜棒抵住锌片的中部,发现铜棒变粗了,一段时间后,被铜棒抵住的部位出现了一个洞口.请你解释这两个现象:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、采用结晶的方法除去氯化钠溶液中的泥沙 |
| B、用酒精萃取溴水中的溴单质 |
| C、用蒸馏的方法分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃) |
| D、用过滤的方法从含有少量氯化钠溶液的硝酸钾溶液中提取硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B与A只能组成BA3化合物 |
| B、C、D、E形成的化合物水溶液可能显碱性 |
| C、A、B、C形成的化合物一定不能发生水解反应 |
| D、E的氧化物对应的水化物只具有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com