
【题目】化学与生产、生活、社会密切相关,下列有关说法不正确的是:
A. 人造纤维和合成橡胶都属于有机高分子化合物
B. 荧光蛋白是一种高分子化合物且能发生水解
C. Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,可以作为饮用水的消毒剂和净化剂
D. 利用次氯酸钠溶液的碱性对餐具和环境消毒
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列有关能量转换的说法正确的是 ( )
A.煤燃烧是化学能全部转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,一定浓度的某酸HA溶液的pH=5,下列有关说正确的是
A. 向溶液中加入适量NaA固体,若溶液pH不变,则HA为强酸
B. 若HA为弱酸,则该溶液导电能力比等体积pH=5的盐酸弱得多
C. 若HA为弱酸,则加入等体积pH=9的NaOH溶液,所得溶液pH>7
D. 取该溶液1.00mL,加水稀释至1000mL,所得溶液pH=8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是( )
A. 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰
C. 化学药品着火,都要立即用水或泡沫灭火器灭火
D. PM2.5中含有铅、铬、钒、砷等对人体有害的金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某50 mL溶液中可能含有H+、Na+、Mg2+、Al3+、SO42-、NH4+离子,当向该溶液中加入5 mol/L的NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积v(NaOH)变化关系如下图所示。
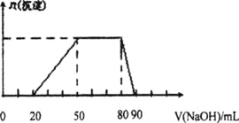
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、SO42-
B. 原溶液中Al3+的浓度为lmol/L
C. 原溶液中NH4+的物质的量为0.4 mol
D. 当加入的NaOH溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)以甲烷为原料可制得氢气。图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量(KJ)变化示意图,写出该反应的热化学方程式_______________(△H用E1、E2、E3表示)。

(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
A.容器内气体压强保持不变
B.吸收y mol H2只需1 mol MHx
C.若降温,该反应的平衡常数增大
D.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-![]() FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH-)降低的区域在__________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_____________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c( Na2FeO4)低于最高值的原因:_____________。
(5)在容积可变的密闭容器中充入10molCO和20molH2,发生CO ( g ) + 2H2 ( g )![]() CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。
CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池.某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液.
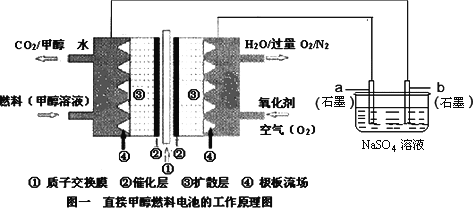
请根据图示回答下列问题:
(1)图中a电极是_____________(填“正极”、“负极”、“阴极”或“阳极”).该电极上发生的电极反应式为__________________.
(2)碱性条件下,通入甲醇的一极发生的电极反应式为________________.
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是____________mol.
(4)若a、b电极材料分别为铁和石墨,则电解总反应化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A. 混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B. 混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C. c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D. c(Na+)=c(Y-)+c(HY)="0.3" mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com