
| A、不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 |
| B、使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大 |
| C、分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出 |
| D、用托盘天平称量11.74 g氯化钠晶体 |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
| A、标况下22.4LH2O中的分子数为NA |
| B、22.4LCl2所含分子数目为NA |
| C、23gNa变成Na+时失去的电子数目为NA |
| D、2g氢气所含原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A、③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 |
| B、分别加水稀释10倍,四种溶液的pH①>②>④>③ |
| C、①④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、VaL②与VbL③溶液混合后,若混合后溶液pH=7,则Va>Vb |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
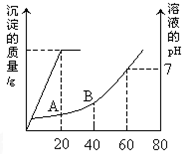 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.45 mol?L-1 |
| D、0.225 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
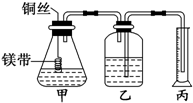 某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度、相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com