
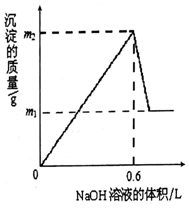
 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
分析 由图可知加NaOH生成沉淀,则酸无剩余,Cu、Al失去电子,N得到电子,且图中酸碱恰好中和时生成沉淀最多,继续加NaOH,氢氧化铝溶解,m1-m2为氢氧化铝的质量,结合电子、原子守恒计算.
解答 解:设合金中Cu为xmol,Al为ymol,则
①64x+27y=m1,
②2x+3y=0.6L×1mol/L=$\frac{V}{22.4}$×(5-2)
③y=$\frac{{m}_{1}}{98}$
解得x=0.1mol,y=0.13mol,V=4.48L,
A.m1-m2为氢氧化铝的质量,为0.13mol×78g/mol=10.2g,故A正确;
B.n(NO)=0.2mol=n(HNO3),n(H+)=0.6mol,n(H2SO4)=$\frac{0.6-0.2}{2}$=0.2mol,2c(H2SO4)+c(HNO3)═0.6 mol•L-1,故B错误;
C.原合金中铝的质量分数为$\frac{0.13mol×27g/mol}{0.1mol×64g/mol+0.13mol×27g/mol}$×100%=34.7%,故C正确;
D.由上述分析可知,V=4.48L,故D错误;
故选BD.
点评 本题考查混合物的计算,为高频考点,把握图象与反应的对应关系、发生的反应为解答的关键,侧重分析与计算能力的考查,注意电子、原子守恒的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型为 ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 二氧化硫、氨、煤的液化均为物理变化 | |
| D. | 实验室中制取乙酸乙酯的方程式为CH3COOH+H18O-C2H5CH3COOC2H5+H218O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
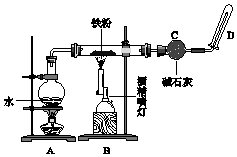 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(2a-b)kJ/mol | |
| B. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4b-a)kJ/mol | |
| C. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(a-4b)kJ/mol | |
| D. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中MnO2是氧化剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:3 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH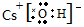 HSCN
HSCN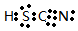 O22-
O22- .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com