
| A. | Fe2+、Mg2+、Al3+ | B. | Mg2+、Al3+、Cu2+ | C. | Fe3+、Cu2+、Zn2+ | D. | Ag+、Cu2+、Zn2+ |
分析 Ag+、Zn2+、Fe3+、Cu2+、Fe2+、Mg2+、Al3+均能与少量的氨水反应生成沉淀AgOH、Zn(OH)2、Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2、Al(OH)3沉淀,但只有AgOH、Zn(OH)2、Cu(OH)2能和过量的氨水形成配离子,使沉淀溶解,据此分析.
解答 解:A、Fe2+、Mg2+、Al3+均能与少量的氨水反应生成沉淀,但当氨水过量时,Fe(OH)2、Mg(OH)2、Al(OH)3沉淀不溶解,故A不选;
B、Mg2+、Al3+、Cu2+均能与少量的氨水反应生成沉淀,但当氨水过量时,Mg(OH)2、Al(OH)3沉淀不溶解,故B错误;
C、Zn2+、Fe3+、Cu2+均能与少量的氨水反应生成沉淀,但当氨水过量时,Fe(OH)3沉淀不溶解,故C错误;
D、Ag+、Cu2+、Zn2+均能与少量的氨水反应生成沉淀,当氨水过量时,AgOH、Zn(OH)2、Cu(OH)2能和过量的氨水形成配离子,使沉淀溶解,故D正确.
故选D.
点评 本题考查了金属离子与碱反应生成沉淀的反应以及得到的沉淀是否溶于过量的氨水,应注意的是AgOH、Zn(OH)2、Cu(OH)2能和过量的氨水形成配离子,使沉淀溶解.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯中C=C的键能是乙烷中C-C的键能的2倍 | |
| B. | 同一原子中,2p,3p,4p能级的轨道数目依次增多 | |
| C. | C-O键的极性比N-O键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
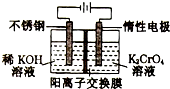 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色 | |
| B. | 在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| C. | 若测得右室中K与Cr的物质的量之比($\frac{nk}{ncr}$)为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比($\frac{nk}{ncr}$)为d,则此时铬酸钾的转化率为2-d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
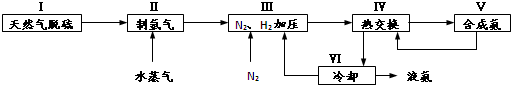
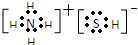 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com