
某气态化合物X含C、H、O三种元素,现已知下列条件:①X中的C的质量分数 ②X中H的质量分数 ③X在标准状况下的体积 ④X对氢气的相对密度 ⑤X的质量。欲确定X的分子式,所需的最少条件是( )
A.①②④ B.②③④
C.①③⑤ D.①②
科目:高中化学 来源: 题型:
反应2SO2+O22SO3达到平衡状态后,下列说法正确的是( )
A.三氧化硫的生成速率与分解速率相等
B.二氧化硫、氧气、三氧化硫的分子数之比是2:1:2
C.二氧化硫与氧气不再化合生成三氧化硫
D.降低温度,原化学平衡状态未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示某气体反应的能量变化示意图,据此分析下列判断错误的是( )
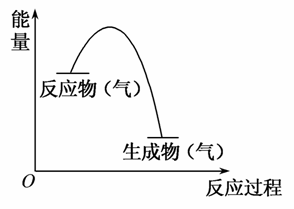
A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N2+===M2++N ②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑。判断它们的还原性由强到弱的顺序是( )
A.M、N、P、E B.P、M、N、E
C.M、N、E、P D.E、P、M、N
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)?________。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:______________________。
②石墨为________极,电极反应式:_____________________。
③电池总反应式:_____________________________________。
(3)实验4中铝作负极还是正极________,理由是______________________________。写出铝电极的电极反应式:__________________________________________________。
(4)解释实验5中电流计指针偏向铝的原因:__________________________________________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3 C. Q3> Q2> Q1 D. Q1=Q2=Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
可以由下列反应合成三聚氰胺:CaO+3C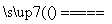 CaC2+CO↑,
CaC2+CO↑,
CaC2+N2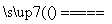 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____ ;CaCN2中阴离子为CN ,与CN
,与CN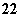 互为等电子体的
互为等电子体的
分子有N2O和________(填化学式),由此可以推知CN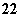 的空间构型为______ __。
的空间构型为______ __。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺(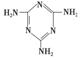 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (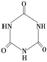 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,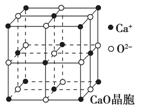 CaO晶体中Ca2+的配位数为 ,
CaO晶体中Ca2+的配位数为 ,
Ca2+采取的堆积方式为 ,
O2-处于Ca2+堆积形成的 空隙中;
CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com