
下列离子方程式书写正确的是( )
A.向明矾溶液中加入过量的氢氧化钡溶液:
Al3++2 SO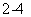 +2Ba2++4OH-===2BaSO4↓+AlO- 2+2H2O
+2Ba2++4OH-===2BaSO4↓+AlO- 2+2H2O
B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
C.向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH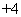 +OH-===NH3·H2O
+OH-===NH3·H2O
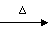 D.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
D.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
CH2BrCOOH+OH- CH2BrCOO-+H2O
科目:高中化学 来源: 题型:
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体 g.
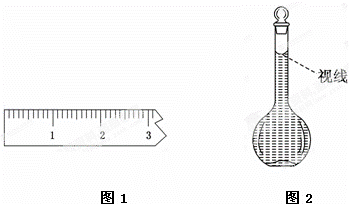
(3)称量.①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的 (填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用 引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、 、 .
(8)在配制过程中,某学生观察定容时液面情况如图2所示,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项表述正确的是( )
A.氢氧化钡的电离方程式为Ba(OH)2=Ba2++2OH-
B.强弱电解质的本质区别是溶液的导电性强弱。
C.电解质与非电解质的本质区别是水溶液能否导电;
D.硫酸氢钠是强电解质,碳酸氢钠是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的保存方法正确的是 ( )
①少量金属钠保存在酒精中 ②浓硝酸盛放在无色试剂瓶中 ③少量白磷保存在水中 ④氢氟酸保存在带塑料盖的密封玻璃瓶中 ⑤氯水存放在带玻璃塞的无色细口瓶中 ⑥碳酸钠固体保存在带橡皮塞的细口瓶中
A.③ B.③④⑥ C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:

| 分子式 | 丙 C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
(1)甲中含氧官能团的名称为________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
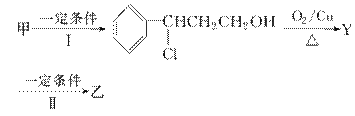
其中反应Ⅰ的反应类型为________,反应Ⅱ的化学方程式为__________________________(注明反应条件)。
(3)已知:RCH===CHR′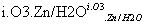 RCHO+R′CHO;
RCHO+R′CHO;
2HCHO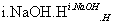 HCOOH+CH3OH
HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
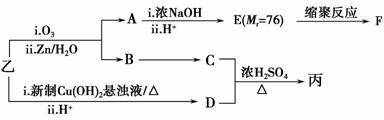
①下列物质不能与C反应的是________(选填序号)。
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②写出F的结构简式_______________________。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式________。
a.苯环上连接三种不同官能团
b.能发生银镜反应
c.能与Br2/CCl4发生加成反应
d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为_________________。
⑤写出乙与新制的Cu(OH)2悬浊液反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g·cm-3。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和X-。为了测定RX的分子量,拟定的实验步骤如下:①准确量取该卤代烷b mL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加入稀硝酸酸化,滴入过量的AgNO3溶液,得到白色沉淀
④过滤、洗涤、干燥后称重,得到固体c g。回答问题:
(1)装置中长玻璃管的作用是________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的________离子。
(3)该卤代烷中所含卤素的名称是____________,判断的依据是_____________。
(4)该卤代烷的分子量是_____________(列出算式)。
(5)如果在步聚③中,加HNO3的量不足,则步骤④中测得的c值将_______。
A.偏大 B.偏小 C.不变 D.大小不定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作所用仪器合理的是
A. 用100 mL 容量瓶配制所需的95 mL 0.1 mol·L-1 NaOH溶液
B. 用50mL烧杯准确量取30.5 mL NaOH溶液
C. 用托盘天平称取25.30gNaCl
D. 用50 mL 量筒量取4.8 mL浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是( )
A.标准状况下,2.24L苯中约含有3.612×1023个碳原子
B.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧原子
C.25℃时,1L pH=13的氢氧化钠溶液中约含有6.02×1023个氢氧根离子
D.1 molCH4中约含有3.01×1024个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是 ( )
A. MnO2 与浓盐酸反应制Cl2: MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. 明矾溶于水产生Al(OH)3 胶体: Al3++3H2O Al(OH)3↓+3H+
Al(OH)3↓+3H+
C. Na2O2 溶于水产生O2: Na2O2+H2O 2Na++2OH-+O2↑
2Na++2OH-+O2↑
D. Ca(HCO3)2溶液与少量NaOH溶液反应: HCO3-+Ca2++OH- CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com