
 .该反应中氧化剂为HNO3,被还原的元素是N,每生成3.36L标准状况下的气体,转移电子数目为0.45NA(或2.709×1023).
.该反应中氧化剂为HNO3,被还原的元素是N,每生成3.36L标准状况下的气体,转移电子数目为0.45NA(或2.709×1023). 分析 (1)①氧化铁与盐酸反应生成氯化铁和水;
②稀硫酸与氢氧化铜反应生成硫酸铜和水;
(2)Cu元素的化合价升高,N元素的化合价降低,该反应转移6e-,反应为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,以此来解答.
解答 解:(1)①用稀盐酸清洗铁锈的离子反应为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
②稀硫酸与氢氧化铜反应的离子反应为Cu(OH)2+2H+=Cu2++2H2O,故答案为:Cu(OH)2+2H+=Cu2++2H2O;
(2)该反应中部分N元素化合价由+5价变为+2价,则氧化剂为HNO3,N元素被还原,对应还原产物为NO,Cu元素化合价由0价变为+2价,则还原剂为Cu,Cu元素被氧化,对应氧化产物为Cu(NO3)2,该反应转移6e-,用双线桥标出该反应电子转移的方向和数目为 ,若反应中转移6mol的电子生成2molNO,每生成3.36L标准状况下的气体,转移电子数目为$\frac{3.36L}{22.4L/mol}$×3×NA=0.45NA(或2.709×1023),
,若反应中转移6mol的电子生成2molNO,每生成3.36L标准状况下的气体,转移电子数目为$\frac{3.36L}{22.4L/mol}$×3×NA=0.45NA(或2.709×1023),
故答案为:4; ;HNO3;N;0.45NA(或2.709×1023).
;HNO3;N;0.45NA(或2.709×1023).
点评 本题考查离子反应及氧化还原反应,为高频考点,把握发生的反应、元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意转移电子的计算,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:实验题
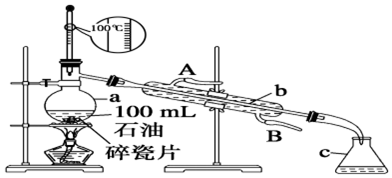
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的特征是元素化合价发生了变化 | |
| B. | 在水溶液中能电离出H+的化合物不一定是酸 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定不相同 | |
| D. | 因为NH3溶于水的溶液能导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O=4HF+O2反应中,水作还原剂,失电子 | |
| B. | 2Na+2H2O=2NaOH+H2↑反应中,水被氧化 | |
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O反应中,H2O是还原产物 | |
| D. | Na2O+H2O=2Na++2OH-反应中,水既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸氢钠的水解:HSO3-+H2O?H3O++SO32- | |
| B. | 甲烷燃料电池(电解质为KOH)负极反应:CH4-8e-+2H2O═CO2+8H+ | |
| C. | 1mol•L-1 NH4A1(SO4)2溶液中逐滴加入等体积4 mol•L-1 NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 用硫酸铜溶液去除硫化氢气体Cu2++H2S═CuS↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
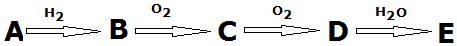
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 阿伏加德罗常数是 12kg12C中含有的碳原子数 | |
| C. | 1molH2O中含有2mol H和1mol O | |
| D. | 一个NO分子的质量是ag,一个NO2分子的质量是bg,则氧原子的摩尔质量是(b-a)g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
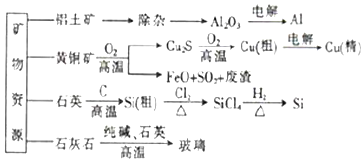
| A. | 制取玻璃和粗硅的同时均产生CO2气体 | |
| B. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用过滤的方法(SiCl4的熔点-70℃,沸点57.7℃) | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com