
| 84 |
| 12 |
| 84 |
| 12 |


科目:高中化学 来源: 题型:
| A、Ca(OH)2溶液中加入少量NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
| B、过量氯气通入FeBr2溶液中:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C、二氧化硫气体通入碘水中:SO2+I2+2H2O=2H++SO42-+2HI |
| D、向明矾溶液中加入Ba(OH)2溶液至沉淀质量最大:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 为原料合成重要的化工产品
为原料合成重要的化工产品 的路线流程图(无机试剂任选)合成路线流程图示例如图2.
的路线流程图(无机试剂任选)合成路线流程图示例如图2.查看答案和解析>>
科目:高中化学 来源: 题型:
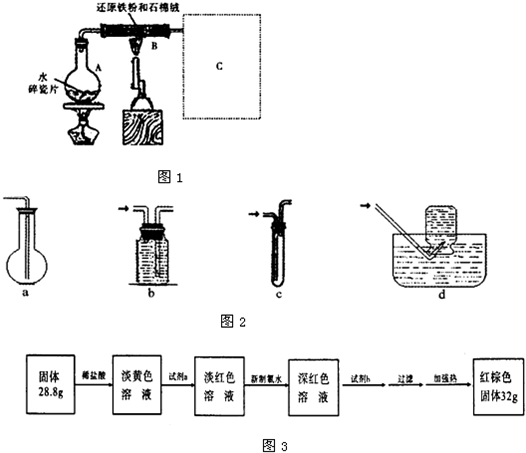
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用焰色反应鉴别氯化钠固体和氢氧化钠固体 |
| B、用丁达尔效应鉴别NaCl溶液和KCl溶液 |
| C、用AgNO3溶液鉴别NaCl溶液和Na2SO4溶液 |
| D、用萃取法鉴别溴水和碘水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
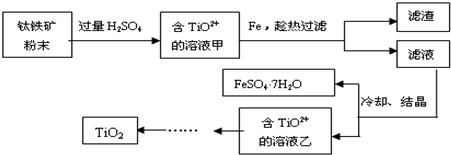

| 400℃ |
| 约1250℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在潮湿的酸性土壤中 |
| B、在潮湿不透气的中性土壤中 |
| C、在干燥致密不透气的土壤中 |
| D、在潮湿透气的盐碱地中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com