
| A. | Fe2O3(Al2O3)用盐酸 | B. | Fe2O3(Al2O3)用氨水 | ||
| C. | Mg(Al)用纯碱溶液 | D. | MgCl2(AlCl3)用氢氧化钠溶液和盐酸 |
分析 A.二者都与盐酸反应;
B.氧化铝与氨水不反应;
C.铝与纯碱不反应;
D.可加入过量氢氧化钠,分别生成氢氧化镁和偏铝酸钠,过滤后再加入盐酸.
解答 解:A.二者都与盐酸反应,除去氧化铝,可加入氢氧化钠溶液,故A错误;
B.氧化铝与氨水不反应,可加入氢氧化钠溶液除杂,故B错误;
C.铝与纯碱不反应,可加入氢氧化钠溶液除杂,故C错误;
D.可加入过量氢氧化钠,分别生成氢氧化镁和偏铝酸钠,过滤后再加入盐酸,又可生成氯化镁、氯化铝,故D正确.
故选D.
点评 本题考查物质的分离、提纯和除杂等问题,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,注意氧化铝的两性.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
在一定温度下,有a盐酸 b、硫酸 c、醋酸三种酸:
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是 。(填序号,下同)
(2)同物质的量浓度的三种酸,中和相同物质的量的NaOH溶液所需酸的体积由大到小的顺序是 。
(3)若三者c(H+)相同时,物质的量浓度大小的顺序是 。
(4)若三者c(H+)相同,体积也相同时,分别放入足量的且同样的锌,相同状况下产生气体的体积由大到小的顺序是 ,生成同体积的气体所需时间由大到小的顺序是 。
(5)将c(H+)相同的三种酸均加水稀释到原来的100倍时,c(H+)由大到小的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
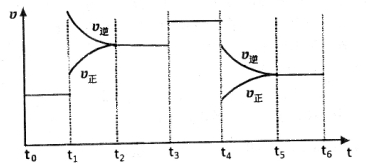
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为4mol/L | |
| B. | 原溶液中c(Cu2+)为1mol/L | |
| C. | 电解后溶液中c(H+)为8mol/L | |
| D. | 电解后加入1molCu(OH)2可使溶液复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
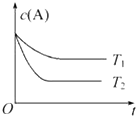 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:解答题
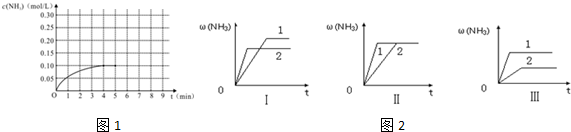
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com