
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S

①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
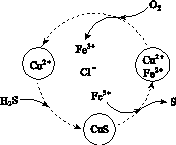
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。

(1)①2H2O+2e-===H2↑+2OH- ②S +2H+===(n-1)S↓+H2S↑
+2H+===(n-1)S↓+H2S↑
(2)①Cu、H、Cl(或铜、氢、氯) ②0.5 mol ③提高混合气体中空气的比例
(3)2H2S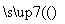 2H2+S2
2H2+S2
[解析] (1)①电解池的阴极发生还原反应,溶液中H2O电离出的H+被还原为H2,即2H2O+2e-===H2↑+2OH-;②在酸性条件下,S2-与H+结合生成H2S,故S 与酸发生反应:S
与酸发生反应:S +2H+===(n-1)S↓+H2S↑。(2)①由图示可知,最终产物为CuS、HCl、S和FeCl3,因而Cu、H、Cl三种元素的化合价未变。②根据电子守恒,1 mol H2S转化为S,失去2 mol电子,而1 mol O2消耗4 mol电子,故1 mol H2S消耗0.5 mol O2。③为了把CuS转化为S,应加入氧化剂,在溶液的量不增加的前提下,只能增加O2的量,即增加空气的量。(3)结合图像可知,体系中有3种组分,说明H2S未完全分解,即属于可逆反应。选取某温度下各组分的体积分数,如选取1300 ℃下各组分的体积分数,结合S原子守恒,推出硫蒸气的组成为S2,可得反应为2H2S
+2H+===(n-1)S↓+H2S↑。(2)①由图示可知,最终产物为CuS、HCl、S和FeCl3,因而Cu、H、Cl三种元素的化合价未变。②根据电子守恒,1 mol H2S转化为S,失去2 mol电子,而1 mol O2消耗4 mol电子,故1 mol H2S消耗0.5 mol O2。③为了把CuS转化为S,应加入氧化剂,在溶液的量不增加的前提下,只能增加O2的量,即增加空气的量。(3)结合图像可知,体系中有3种组分,说明H2S未完全分解,即属于可逆反应。选取某温度下各组分的体积分数,如选取1300 ℃下各组分的体积分数,结合S原子守恒,推出硫蒸气的组成为S2,可得反应为2H2S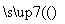 2H2+S2。
2H2+S2。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1(b-2a) mol/L B.10(2a-b) mol/L
C.10(b-a) mol/L  D.10(b-2a) mol/L
D.10(b-2a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是( )
①钠的化合物 ②能与硝酸反应的物质 ③可溶于水的物质 ④电解质 ⑤钠盐 ⑥钠的含氧化合物
A.①③④⑤ B.①②⑤⑥
C.②⑤⑥ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是( )
A.Cu溶于稀HNO3:
Cu+2H++NO ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制
Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
C.用CH3COOH溶解CaCO3:
CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:
CO2+AlO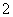 +2H2O===Al(OH)3↓+HCO
+2H2O===Al(OH)3↓+HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期、第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_______________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________,阴极上观察到的现象是____________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________________,这样做的主要缺点是____________________。
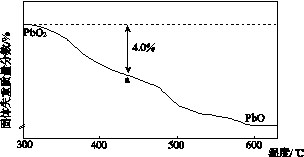
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即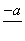 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
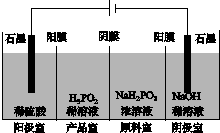
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S

①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。

①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
关于乙醇的说法不正确的是( )
A.乙醇是具有特殊气味的液体
B.乙醇分子里含有6个氢原子,它们的性质是完全一样的
C.乙醇易挥发,与水任意比互溶
D.乙酸的熔沸点比乙醇高
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中不能大量共存的离子组是( )
①NH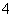 、Ag+、PO
、Ag+、PO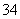 、Cl-
、Cl-
②Fe3+、H+、I-、HCO
③Al3+、Mg2+、SO 、CO
、CO
④在pH=12的溶液中,K+、Cl-、HCO 、Na+
、Na+
⑤在pH=0的溶液中,Na+、NO 、SO
、SO 、K+
、K+
A.仅①③④ B.仅①②③
C.全部 D.仅①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com