
【题目】用A和B为原料合成E的路线如下。已知B的分子式为C2H2O3 ,可发生银镜反应且具有酸性,回答下列问题:

(1)E中含氧官能团的名称为_____________________。
(2)A的名称为_________。写出B 发生银镜反应的化学方程式_________________。
(3)C→D反应的化学方程式为____________,D→E的反应类型是_____________。
(4)写出符合下列条件的C的所有同分异构体(不考虑立体异构)的结构简式___________。
①属于羧酸类芳香化合物 ②核磁共振氢谱中出现4组峰
(5)设计由乙酸为起始原料制备OHC-COOH 的合成路线(无机原料任选):
CH3COOH ClCH2COOH ________________________________________。
ClCH2COOH ________________________________________。
【答案】酯基、(酚)羟基 苯酚 ![]()
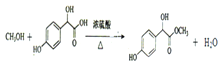 取代反应
取代反应 ![]() 、
、 ![]()
![]()
【解析】
(1)E中含氧官能团为羟基,和酯基,答案为羟基 酯基;
(2)B的分子式为C2H2O3,可以发生银镜反应还有酸性,不饱和度为2,3个原子,恰好为1个—COOH,1个—CHO,C的分子式C8H8O4,—CHO 变成CHOH,碳氧双键打开,A和B发生加成,A的分子式为C6H6O,C中含有酚羟基,A为苯酚。B发生银镜反应,B中有羧基,羧基可以与NH3反应。答案为苯酚
![]() ;
;
(3)C到D的反应条件,浓硫酸加热,并且E中含有酯基,那么C到D为酯化反应。D到E的反应条件,浓氢溴酸加热,且C中醇羟基的部分,变为溴原子,为取代反应。答案为![]() 取代反应;
取代反应;
(4)C的同分异构体中含羧基,除去苯环,还有2个—OH,1个—CH3。但是核磁共振氢谱只有4组峰,羧基占了一组峰,其他苯环的氢或者侧链上的氢只能有3组峰,可从对称位置入手。答案为![]()
![]() ;
;
(5)乙酸制备OHC-COOH,原乙酸中的甲基变成了醛基,第一步已经给出,甲基上已经引入了氯原子,到醛基,先水解,成醇,醇氧化成醛。答案为![]() 。
。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若配制90mL0.1mol/L的FeCl3溶液,需要用到的仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管,还需要的仪器是( )
A.100mL圆底烧瓶B.100mL量筒
C.100mL容量瓶D.100mL烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
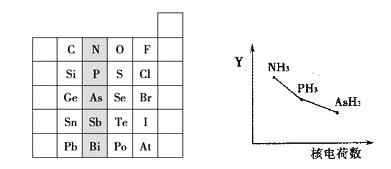
⑴ 阴影部分元素的外围电子排布式的通式为_________。Sb的元素名称为________。基态P原子中,电子占据的最高能级符号为______,该能层具有的原子轨道数为______。
⑵ 氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如上右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
A.稳定性B.沸点C.R—H键能D.分子间作用力
⑶ 某种新型储氧材料的理论结构模型如下左图所示,图中虚线框内碳原子的杂化轨道类型有____________种。

⑷ CN-和Fe2+、Fe3+及K+能形成一种蓝色配位化合物普鲁士蓝。上右图是该物质的的结构单元(K+未标出),该图是普鲁士蓝的晶胞吗?_______ (填“是”或“不是”),平均每个晶胞中含有______个K+。

⑸磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是{SiO4}四面体,多磷酸盐中是{PO4}四面体。右图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法正确的是
A. 1.0molCH4与3.0molCl2光照下反应生成的CHCl3分子数为1.0NA
B. 1.0mol·L-1的(NH4)3PO4溶液中阳离子数为3.0NA
C. 5.6gFe与过量浓盐酸完全反应转移的电子数为0.2NA
D. 常温下2.24LSO3中含有的质子数为4.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MoS2(辉钼矿的主要成分)可用于制取钼的化合物润滑添加剂氢化反应和异构化反应的催化剂等。回答下列问题:
(1)反应3MoS2+18HNO3+12HCl=3H2[MoO2Cl4]+18NO↑+6H2SO4+6H2O中,每溶解1mol MoS2,转移电子的物质的量为___________。
(2)已知:MoS2(s)= Mo(s)+S2(g) △H1
S2(g)+2O2(g)=2SO2(g) △H2
2MoS(s)+7O2(g)=2MoO3 (s)+4SO2(g) △H3
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=___________(用含△H1、△H2、△H3的代数式表示)。
(3)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液(装置如图所示)。

①阴极的电极反应式为______________________。
②一段时间后,电解液的pH___________ (填“增大”“减小”或“不变”),MoO42-在电极___________(填“A”或“B”)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________________。
(4)用辉钼矿冶炼Mo的反应为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
①该反应的△H___________(填“>”或“<”)0;p1、p2、p3按从小到大的顺序为___________。
②在某恒容密闭容器中加入0.1 mol MoS2、0.2mol Na2CO3、0.4mol H2,一定温度下发生上述反应,下列叙述说明反应已达到平衡状态的是____________ (填标号)。
a.v正(H2)=v逆(CO)
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d单位时间内断裂H一H键与断裂H—O键的数目相等
③在2L的恒温恒容密闭容器中加入0.1 mol MoS2、0.2 mol Na2CO3、0.4molH2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值(NA)有关的说法中,不正确的是
A. 18g H218O与D2O的混合物中,中子数为9NA
B. 标准状况下,22.4 L Cl2与NaOH溶液完全反应时转移电子的数为NA
C. 1L0.1 mol L-1NH4NO3溶液中加稀氨水,溶液呈中性时NH![]() 数为0.1NA
数为0.1NA
D. 4.6 gC2H6O中含有的C—H数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol/LCH3COOH溶液加水稀释或升高温度的过程中,下列表达式的数值一定变大的是
A. c(H+) B. c(H+)·c(OH-) C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com