
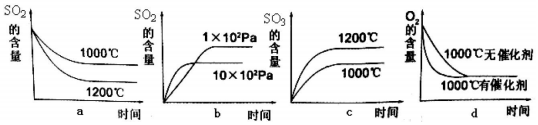
分析 (1)a.该反应为放热反应,升高温度,反应速率加快,平衡逆向移动;
b.该反应为气体体积减小的反应,压强越大,反应速率越快,平衡正向移动;
c.升高温度,反应速率加快,平衡逆向移动;
d.催化剂对平衡移动无影响,可加快反应速率;
(2)500℃与催化剂的活性、反应速率有关.
解答 解:(1)a.该反应为放热反应,升高温度,反应速率加快,平衡逆向移动,则温度高时SO2的含量大,图中不符,故不选;
b.该反应为气体体积减小的反应,压强越大,反应速率越快,平衡正向移动,与图象一致,故选;
c.升高温度,反应速率加快,平衡逆向移动,则温度高时SO3的含量小,图中不符,故不选;
d.催化剂对平衡移动无影响,可加快反应速率,与图象一致,故选;
故答案为:bd;
(2)实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是催化剂的活性较高、加快反应速率,
故答案为:催化剂的活性较高、加快反应速率.
点评 本题考查化学平衡移动,为高频考点,把握平衡移动原理与图象、实际生产中的应用为解答本题的关键,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶格能指形成1mol离子键所放出的能量 | |
| B. | 晶格能指破坏1mol离子键所吸收的能量 | |
| C. | 晶格能指1mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量 | |
| D. | 晶格能的大小与晶体的熔点,硬度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 一只钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 | |
| C. | FeCl3溶液加入NaOH溶液产生红褐色沉淀 | |
| D. | 水泥厂、冶金厂常用高压电除工厂烟尘,以减少对空气的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com