
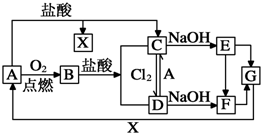
 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.
已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题. .
.分析 A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3,据此解答.
解答 解:A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3,
(1)由上述分析可知,B为Fe3O4,C为FeCl2,
故答案为:Fe3O4;FeCl2;
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+,
故答案为:KSCN溶液;溶液变红色;
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,
故答案为:防止Fe2+被氧气氧化;
(4)E转化为F是氢氧化亚铁被氧气氧化生成氢氧化铁,现象是:白色沉淀迅速变成灰绿色,最后变成红褐色;反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,该反应中铁元素化合价由+4价变为+6价,氧元素化合价由0价变为-2价,得失电子数为4,所以其转移电子的方向和数目为:
故答案为:白色沉淀迅速变成灰绿色,最后变成红褐色;
(5)①A→C的反应离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
②C→D的反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查无机物推断,涉及Fe元素单质化合物的性质及转化,物质的颜色是推断突破口,再结合转化关系推断各物质,掌握元素化合物的性质是解题的关键.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:推断题
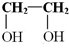
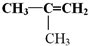 为原料通过下列反应来制取有机玻璃:
为原料通过下列反应来制取有机玻璃: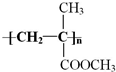
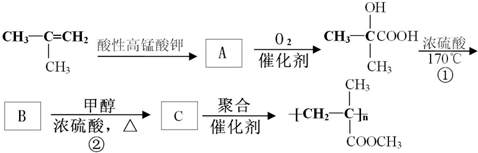
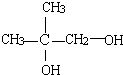 B.
B.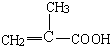 C.
C.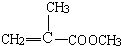
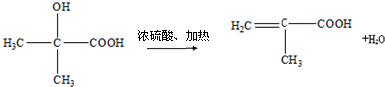 ;反应②:
;反应②: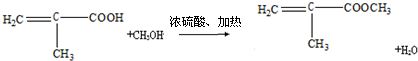 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
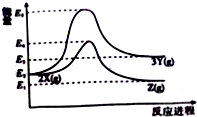
| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 升高温度有利于提高Z的产率 | |
| C. | 由X→Y的反应,增加压强有利于提高X的转化率 | |
| D. | 由X→Z反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 苯 | 溴单质 | 加亚硫酸钠溶液洗涤,分液 |
| B | 淀粉胶体 | 葡萄糖 | 水,过滤 |
| C | 甲烷 | 乙烯 | 通入酸性高锰酸钾溶液,洗气 |
| D | 乙酸乙酯 | 乙酸 | 加入氢氧化钠溶液,分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图a表示的是吸热反应的能量变化 | |
| B. | 图b中反应物比生成物稳定 | |
| C. | 图b可以表示氧化钙与水反应的能量变化 | |
| D. | 图a不需要加热就一定能发生,图b一定需要加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| B. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| C. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA | |
| D. | 11.2 L标况下的SO3所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)等于1×10-7 mol•L-1的溶液一定是中性溶液 | |
| B. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| C. | 室温时,pH=2的CH3COOH和0.01 mol•L-1 NaOH溶液等体积混合,混合后pH=7 | |
| D. | 等物质的量浓度的Na2S和NaHS混合溶液中:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
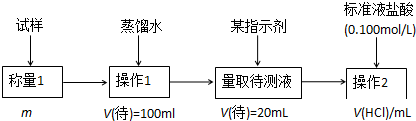
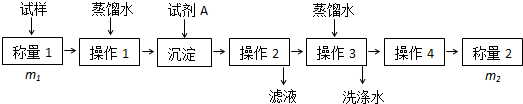
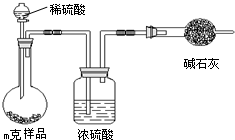
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com