
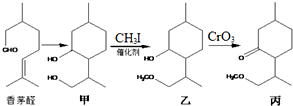
| A. | 香茅醛能发生加聚反应和缩聚反应 | |
| B. | “甲→乙”发生了取代反应 | |
| C. | 甲中不同化学环境的羟基化学性质不同 | |
| D. | 香茅醛存在顺反异构现象 |
分析 A.香茅醛含有碳碳双键,能发生加聚反应,含有醛基,能与酚发生缩聚反应;
B.甲→乙是羟基中H原子被甲基取代;
C.-CH2OH氧化能得到-COOH,而环上的羟基不能氧化得到羧基;
D.碳碳双键中其中1个不饱和碳原子连接2个甲基.
解答 解:A.香茅醛含有碳碳双键,能发生加聚反应,含有醛基,能与酚发生缩聚反应,故A正确;
B.甲→乙是羟基中H原子被甲基取代,属于取代反应,故B正确;
C.-CH2OH氧化能得到-COOH,而环上的羟基不能氧化得到羧基,化学性质体现不同性,故C正确;
D.碳碳双键中其中1个不饱和碳原子连接2个甲基,不存在顺反异构,故D错误.
故选:D.
点评 本题考查有机物的结构与性质,熟练掌握官能团的性质、有机反应类型,A中醛发生的缩聚反应为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 朴硝和消石加强热都不分解 | |
| B. | 朴硝和消石都属于强电解质 | |
| C. | 朴硝和消石都既含有离子键又含有共价键 | |
| D. | “紫青烟起”是由于消石中的K+在火焰上灼烧时呈现出特殊颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 有机化合物 | 同分异构体数目 |
| A | 分子式为C8H10的芳香烃 | 3种 |
| B | 分子式为C4H8的烯烃 | 2种 |
| C | 分子式为C6H12O2的羧酸 | 8种 |
| D | 分子式为C4H10O的醇 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将气体X通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| B | 向淀粉溶液中加入稀H2SO4,水浴加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 表明淀粉没有水解生成葡萄糖 |
| C | 向含有Cl-和SO42-溶液中,加入过量的硝酸化的Ba(NO3)2溶液,过滤,向滤液中再滴加AgNO3溶液 | 有白色沉淀生成 | 证明溶液中有Cl- |
| D | 向盛有5mL0.005mol•L-1 FeCl3溶液的试管中加入5mL0.01mol•L 1KSCN溶液后,再加入4滴0.1mol•L -1KSCN溶液 | 溶液红色加深 | Fe3++3SCN-?Fe(SCN)3可逆反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>X>W | |
| B. | 气态氢化物的热稳定性:Y<Z | |
| C. | 简单阴离子的还原性:Y>X | |
| D. | 最高价氧化物对应的水化物的酸性:Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
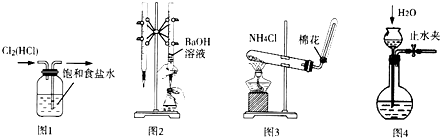
| A. | 用图l所示装置除去Cl2中的HCl杂质 | |
| B. | 用图2所示装置用标准浓度的氢氧化钠溶液测定盐酸的浓度 | |
| C. | 用图3所示装置实验室制取NH3 | |
| D. | 用图4所示装置检查装置气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
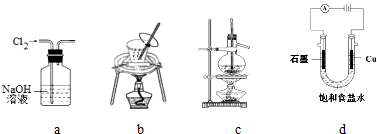
| A. | 用图a所示装置除去Cl2中含有的HCl | |
| B. | 用图b所示装置从饱和食盐水中提取氯化钠 | |
| C. | 用图c所示装置制取乙烯气体 | |
| D. | 用图d所示装置制取Cl2、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
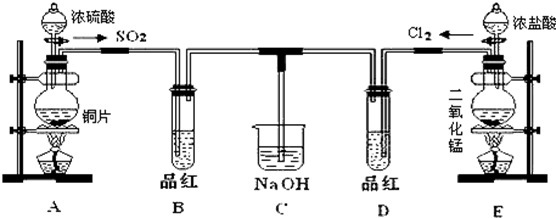

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com