
分析 (1)醋酸是弱电解质,在溶液中部分电离;
(2)氯化铵在溶液中电离出铵根离子,铵根离子结合水电离的氢氧根离子生成一水合氨和氢离子,溶液显示酸性;
(3)AgCl悬浊液中加入浓Na2S溶液,结果白色固体完全转化为黑色固体,说明硫化银溶解度小于氯化银,实现了沉淀转化,氯化银白色沉淀转化为为黑色的Ag2S沉淀.
解答 解:(1)醋酸是弱电解质,在溶液中部分电离,则电离方程式为CH3COOH?H++CH3COO-,故答案为:CH3COOH?H++CH3COO-;
(2)铵根离子在溶液中水解生成一水合氨和氢离子,水解方程式为:NH4++H2O?NH3•H2O+H+,故答案为:NH4++H2O?NH3•H2O+H+;
(3)AgCl悬浊液中加入浓Na2S溶液,结果白色固体完全转化为黑色固体,说明硫化银溶解度小于氯化银,实现了沉淀转化,转化的离子方程式为2AgCl+S2-?Ag2S+2Cl-,故答案为:2AgCl+S2-?Ag2S+2Cl-.
点评 本题考查了电离方程式、水解方程式以及离子方程式的书写,题目难度不大,注意掌握离子方程式、水解方程式以及离子方程式的书写原则,明确强电解质、弱电解质的概念及判断方法,试题培养了学生灵活应用所学知识的能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA | |
| B. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 | |
| C. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.01NA | |
| D. | 10mL5mol/L(NH4)2SO4溶液中含有NH+4数目为0.2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快化学反应速率 | B. | 减小压强能减慢化学反应速率 | ||
| C. | 反应生成SO3的物质的量小于2 mol | D. | 达平衡时反应即停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 在两支试管中分别加入已打磨的一小段镁条和一小块铝片,分别加入2mol•L-1盐酸2mL,发现镁条反应较剧烈 | 金属性:镁强于铝 |
| B | 滴有少量水的小木板上放上小烧杯,加入20gBa(OH)2•8H2O和10gNH4Cl,用玻璃棒快速搅拌并触摸烧杯外壁下部,发现很冷 | Ba(OH)2•8H2O与NH4Cl的反应为吸热反应 |
| C | 浸透石蜡的矿渣棉用喷灯加热,产生的气体通入酸性KMnO4溶液,溶液褪色 | 产生的气体中可能含乙烯、丙烯等烯烃 |
| D | 向5mL0.1mol•L-1 FeCl3溶液中滴入0.1mol•L-1KI溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,溶液变红 | Fe3+与I-的反应有一定限度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | C(I-)/mol•L | C(S2O82-)/mol•L | t/s |
| 1 | 0.040 | 0.040 | 88.0 |
| 2 | 0.080 | 0.040 | 44.0 |
| 3 | 0.080 | 0.080 | 22.0 |
| 4 | 0.160 | 0.020 | 44.0 |
| 5 | 0.120 | 0.040 | 29.3 |
| A. | I-的浓度越大,反应速率越快 | |
| B. | S2O82- 的浓度越大,反应速率越快 | |
| C. | 该实验的目的是研究 I- 与S2O82- 的浓度对反应速率的影响 | |
| D. | 5个实验中,编号3对应浓度的实验,反应速率最慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应要吸收能量 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 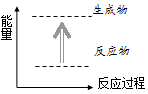 如图所示的反应为放热反应 | |
| D. | 化学键断裂放出能量,化学键生成吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: | B. | 2-氯-1,3-丁二烯的键线式: | ||
| C. | 甲醇的电子式: | D. | 丙烷分子的球棍模型示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应过程中浓硝酸仅体现氧化性 | |
| B. | 该合金中铁与铜物质的量之比是2:1 | |
| C. | 混合气体中,NO2的体积分数是$\frac{1}{3}$ | |
| D. | 金属离子全部沉淀时,加入NaOH溶液的体积至少为1150 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +HCl.
+HCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com