
分析 在同温同压下,同体积的甲烷(CH4)和二氧化碳含有相同分子数目、相同的物质的量,根据分子构成计算原子数之比,根据m=nM计算二者质量之比,密度之比等于质量之比.
解答 解:同温同压下,气体摩尔体积相等,若甲烷(CH4)和氨气(NH3)的体积相同,其物质的量相等,则原子数目之比为5:4;由m=nM知,二者的质量之比等于其摩尔质量之比=16g/mol:17g/mol=16:17;同温同压下,气体的密度之比等于其摩尔质量之比,所以二者的密度之比=16g/mol:17g/mol=16:17;
故答案为:5:4;16:17;16:17.
点评 本题考查阿伏伽德罗定律及其推理、物质的量有关计算,题目难度不大,有利于基础知识的巩固,主要把握物质的量的有关公式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 物质序号 | 被提纯物(杂质) | 试剂 | 分离方法 |
| ① | CH3CH3(CH2=CH2) | ||
| ② | CH2=CH2(SO2) | ||
| ③ | 乙酸乙酯(乙酸) | ||
| ④ | 乙醇(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2 | B. | NaOH | C. | NaHCO3 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④>⑤ | B. | ②>①>⑤>④>③ | C. | ③>④>⑤>①>② | D. | ⑤>④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
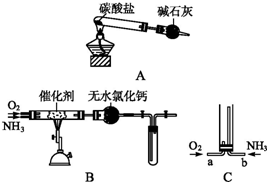
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
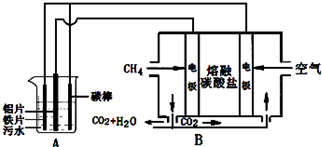
| A. | 装置A中碳棒为阴极 | |
| B. | 污水中加入适量的硫酸钠,可增强溶液的导电性 | |
| C. | 装置B中通入空气的电极反应是O2+2H2O+4e-=4OH- | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS在水中的电离方程式为:NaHS═Na++H++S2- | |
| B. | 已知某温度下Ksp(CH3COOAg)=2.8×10-3,此温度下浓度均为0.1 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 | |
| C. | 0.1mol/L CH3COOH溶液与0.05mol/L NaOH溶液等体积混合,所得溶液中:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) | |
| D. | 0.2mol/LNH3•H2O溶液与0.1mol/L盐酸等体积混合后,溶液显碱性,则:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
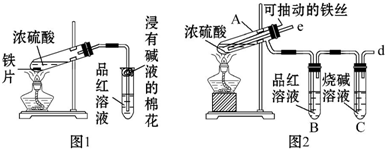
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com