
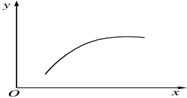
 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )| 选项 | x | y |
| A | 温度 | 混合气体的平均相对分子质量 |
| B | 压强 | A的百分含量 |
| C | 再通入A | B的转化率 |
| D | 加入催化剂 | A的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
分析 反应2A(g)+B(g)?2C(g)△H<0,增加A的量,促进B的转化,加入C,化学平衡逆向移动,增大压强,平衡正向移动,升高温度,化学平衡逆向移动,加入催化剂不影响化学平衡,结合图象可知一个量增大引起另一个量的增大来解答.
解答 解:A.根据方程式可知,此反应是放热的可逆反应,所以升高温度平衡向逆反应方向移动,但混合气体的平均相对分子质量不变,故A错误;
B.改变压强,平衡不移动,A的含量不变,故B错误;
C.增加A的浓度,平衡向正反应方向移动,B的转化率增大,故C正确;
D.催化剂不能改变平衡状态,所以A的含量是不变的,故D错误.
故选C.
点评 本题考查化学平衡的影响因素及化学平衡图象,明确不同因素对化学平衡的影响及由图象得出一个量增大引起另一个量的增大是解答本题的关键.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ/mol | |
| B. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ/mol | |
| C. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ/mol | |
| D. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10min内,Y的平均反应速率为0.03 mol•Lˉ1•sˉ1 | |
| B. | 第10min时,X的反应速率为0.01 mol•Lˉ1•minˉ1 | |
| C. | 10min内,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
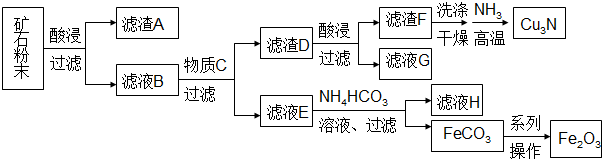
| A. | 每生成1mol Cu3N,转移的电子为6mol | |
| B. | 滤液G可以并入滤液E加以利用 | |
| C. | 加入NH4HCO3溶液需控制温度以抑制Fe2+水解和NH4HCO3分解 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 | |
| D. | 根据步骤Ⅱ可以得出,m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
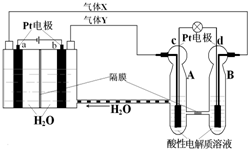 RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )| A. | c电极发生还原反应,B池中H+通过隔膜进入A池 | |
| B. | b电极上发生的电极反应是:2H2O+2e-═H2↑+2OH- | |
| C. | 转移0.1mol电子时,a电极产生标准状况O21.12L | |
| D. | d电极上发生的电极反应是:O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
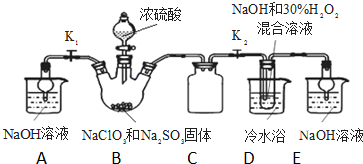 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若溶液pH=7,则c(A-)=c(HA) | |
| B. | 若c(A-)>c(HA),则溶液中水电离的c(H+)<1.0×10-7mol/L | |
| C. | 若pH>7,加水稀释c(A-)/c(HA)增大 | |
| D. | 溶液中,c(A-)=2c(H+)+c(HA)-2c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com