
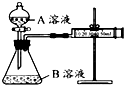
 某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:
某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L-1 H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| ② | 2mL 0.1mol/L -1H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| 实验 编号 | 温度/℃ | 烧杯中所加的试剂及其用量 (mL) | 加入 少量固体 | 溶液褪色 时间(s) | |||
| 0.6mol•L-1 H2C2O4溶液 | H O | 0.2mol•L-1 KMnO4溶液 | 3mol•L-1 稀硫酸 | ||||
| ① | 25 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| ② | 50 | V1 | V2 | 30.0 | 20.0 | 无 | 1.0 |
| ③ | 25 | 15.0 | V3 | 15.0 | 10.0 | 无 | 3.6 |
| ④ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| ⑤ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
分析 (1)高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;
(2)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;判断反应速率需要时间,用秒表计时;
(3)若实验①②是探究温度对化学反应速率影响,那么其他条件要一样,所以V1=30.0,V2=20.0;根据实验④、⑤的区别:加入的分别是硫酸钾和硫酸锰,阳离子不一样,反应速率不同来回答;
(4)A.根据5组实验中,溶液的总体积是100mL来回答;
B.实验①、③中,根据草酸、高锰酸钾以及硫酸的量各不一样来回答;
C.实验①、⑤的区别是一个加入硫酸锰固体,一个开始就没有加入硫酸锰固体,根据反应会生成硫酸锰来回答.
解答 解:(1)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O;
(2)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;
判断反应速率v=$\frac{△C}{△t}$,需要测定时间,可用秒表计时;
故答案为:浓度;秒表;
(3)若实验①②是探究温度对化学反应速率影响,那么其他条件要一样,所以V1=30.0,V2=20.0;根据实验④、⑤的区别:加入的分别是硫酸钾和硫酸锰,⑤的反应速率快说明是产物中的硫酸锰起到了催化作用,故答案为:30.0;探究产物是否对反应有催化作用;
(4)A.根据5组实验中,溶液的总体积是100mL,为保证实验各物质所在的溶液体积相等,保证实验的意义,所以实验③中V3=60,故A错误;
B.实验①、③中,草酸、高锰酸钾以及硫酸的量物质的量各不一样来,混合后的浓度各不相同,所以实验①、③说明反应速率与草酸、硫酸、KMnO4浓度有关,故B错误;
C.实验①、⑤的区别是一个开始就加入硫酸锰固体,一个开始就没有加入硫酸锰固体,根据结果是开始就加入硫酸锰固体的反应速率快,所以可推出实验①中反应速率变化:起初较小,后来生成硫酸锰,速率明显变大,最后物质的浓度减小,所以速率又逐渐变小,故C正确.
故选C.
点评 本题以探究实验为基础,考查影响化学反应速率的因素、化学实验基本操作、氧化还原反应基础知识等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
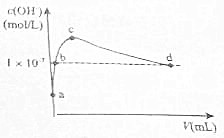 在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )
在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10m01•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7m01•L-1 | |
| C. | c点溶液中:c(K+)>c(HT-)>c(T2-) | |
| D. | d点溶液中:c(K+)=2c(T2-)+c(HT-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
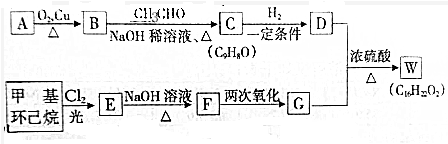
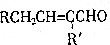 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)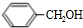 ;C中含有的官能团为碳碳双键、醛基(写名称).
;C中含有的官能团为碳碳双键、醛基(写名称).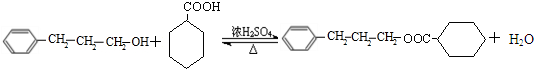 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浊液a中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) | |
| B. | 若向滤液b中滴加0.01mol•L-1Na2SO4溶液,无明显现象 | |
| C. | 若向滤液b中滴加0.01mol•L-1BaCl2溶液,会出现白色沉淀 | |
| D. | 若向滤液b中滴加0.01mol•L-1AgNO3溶液,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物所具有的总能量等于生成物所具有的总能量 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 反应达平衡后,使用催化剂,不能使平衡向右移动 | |
| D. | 当n(N2):n(H2)=1:3时,一定达化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
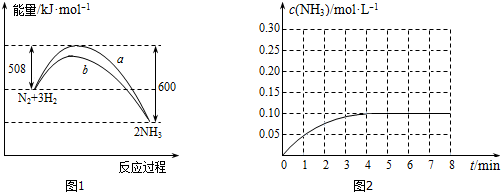
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).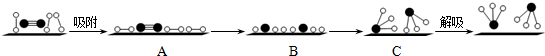
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com