
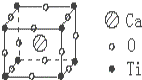
 已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )| A. | CaTiO3 | B. | CaTiO6 | C. | Ca4TiO3 | D. | CaTiO12 |
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与A | B. | C与D | C. | D与B | D. | B与C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋蒸熏对房间消毒杀菌 | |
| B. | SO2通入品红中溶液变为无色 | |
| C. | 红糖水中加入活性炭溶液变为无色 | |
| D. | 少量胆矾粉末加入到浓硫酸中固体变白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
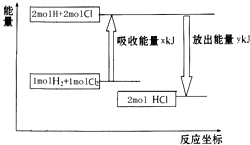
| A. | 该反应是放热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl 键放出x kJ能量 | |
| C. | 断裂1 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CH4中的C2H4杂质选用溴的CCl4溶液 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 甲苯和乙烯都可与酸性高锰酸钾溶液发生化学反应造成酸性高锰酸钾溶液褪色 | |
| D. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相 关 信 息 |
| R | R在周期表中的周期数、族序数与其原子序数均相等 |
| X | X原子形成的化合物种类最多 |
| Y | Y的氢化物与其最高价氧化物的水化物化合生成一种盐 |
| Z | Z原子的最外层电子数为K层电子数的3倍 |
| Q | Q存在质量数为23,中子数为12的核素 |
| w | W在所处周期中原子半径最小 |
 .R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.
.R、X、Z可以形成X2R6Z2化合物,1mol该物质与足量的金属钠反应生成1mol氢气,则该物质的结构简式是CH2OHCH2OH,请写出该物质的一种主要用途汽车发动机的抗冻剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂
CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂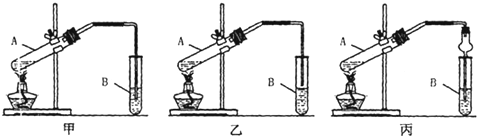
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com