
用惰性电极按如图中装置完成实验,其中A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A烧杯溶液中NaOH的质量分数为10.23%。试回答下列问题:
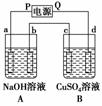
(1)电源的P极为________极。
(2)b极产生气体的体积为________L(标准状况)。
(3)c极上析出沉淀的质量为________g。
(4)d极上所发生的电极反应为__________________________________________________________。
科目:高中化学 来源: 题型:
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示:

下列说法不正确的是( )。
A.氨可用作制冷剂
B.铵态氮肥一般不能与碱性化肥混合使用
C.硝酸可用于制化肥、农药、炸药、染料、盐类等
D.某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
________________________________________________________________________
_______________________________________________________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=________,V6=________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
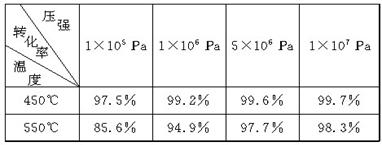
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
(3) 实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4) 在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三个电解池,A池内盛有CuCl2溶液,纯铜片作阴极,B与C两池内均盛有AgNO3溶液,纯银丝作阴极。当B池中银丝质量增加0.108 g、C池中银丝质量增加0.216 g时,A池中铜片质量增加( )
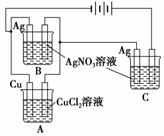
A.0.216 g B.0.108 g
C.0.064 g D.0.032 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质能使品红溶液褪色,且褪色原理基本相同的组合是( )
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④ B.②③⑤
C.②④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取SO2的反应原理为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
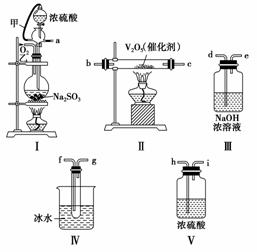
(1)这些装置的连接顺序(按气体从左到右的方向)是________→________→________→________→________→________→________→________(填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是__________________________________________________________
__________________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________________
__________________________________________________________。
(4)Ⅳ处观察到的现象是__________________________________________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会________(填“增大”、“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,对pH=3的醋酸溶液(Ⅰ)和pH=11的氢氧化钠溶液(Ⅱ),下列说法正确的是( )
A.Ⅰ和Ⅱ的物质的量浓度均为0.001 mol·L-1
B.将Ⅰ稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小
C.Ⅰ和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量
D.Ⅰ和Ⅱ等体积混合后,溶液中离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为______________,为何此种情况能测出NaOH的含量?________________。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?________________________________________________________________________,
请说明理由:__________________________________________________________________。
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合

溶液稀释至250 mL,然后用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O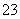 ===2I-+S4O
===2I-+S4O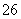 )。取用Na2S2O3的标准溶液应该用________式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
)。取用Na2S2O3的标准溶液应该用________式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
| 滴定次数 | 待测液的 体积(mL) | 滴定前的 读数(mL) | 滴定后的 读数(mL) |
| 第一次 | 25.00 | 0.00 | V=________ |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________,下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com