
科目:高中化学 来源: 题型:多选题
| A. | 分别用炒锅加热两种样品,全部分解挥发,没有物质残留的是小苏打 | |
| B. | 先将两样品配成溶液,分别加入CaCl2,无白色沉淀生成的是小苏打 | |
| C. | 两只小玻璃杯,分别加入少量两种样品,再加入等浓度等体积的食醋,产生气泡快的是小苏打 | |
| D. | 先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
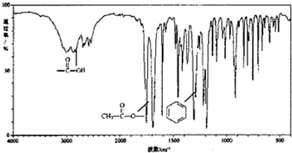 有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图:
有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
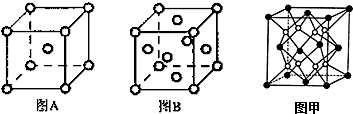 X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示): ,其基态原子有26种运动状态不同的电子;
,其基态原子有26种运动状态不同的电子;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O含有的H2O分子数为NA | |
| B. | 1mol金属镁与足量的盐酸完全反应,转移的电子数为2NA | |
| C. | 11.2L氧气含有的O2分子数为0.5NA | |
| D. | 将含1molFeCl3的溶液与沸水完全反应,生成的Fe(OH)3胶体粒子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
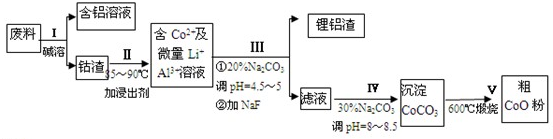
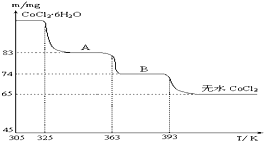
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3能与酸反应,但不能与碱反应 | |
| B. | FeO在空气中受热,会被氧化为Fe3O4 | |
| C. | Na2O2既有氧化性又有还原性,故Na2O2属于两性氧化物 | |
| D. | Na2O和Na2O2中阴、阳离子个数之比分别为1:2 和1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com