
【题目】DCCNa (二氯异氰尿酸钠)固体是一种高效、安全的消毒剂。20℃以上易溶于水。(CNO)3H3 (氰尿酸)为三元弱酸。
I.制备DCCA (二氯异氰尿酸)装置如图。主要反应有:
碱溶 (CNO)3H3+ 2NaOH=(CNO)3Na2H + 2H2O △H<0
氯化 (CNO)3Na2H +2Cl2=(CNO)3Cl2H + 2NaCl H<0
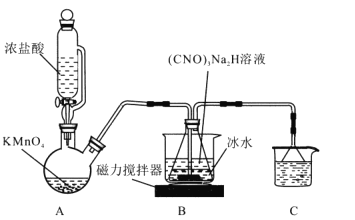
回答下列问题:
(1)装置C中的溶液是______________,作用为______________。
(2)装置A中反应的离子方程式为_______________。
(3)装置B用冰水浴的原因是__________, 碱溶时若氢氧化钠过量,(CNO)3Na2H中可能混有的杂质是__________。
Ⅱ.制备DCCNa
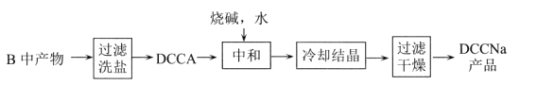
(4)步骤II中过滤洗盐”洗去的盐是__________________。
(5)“中和”反应的化学方程式为_________________。
(6)氧元素含量的测定:称取0. 1000 g DCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用淀粉作指示剂, 用01000 mol·L-1Na2S2O3标准溶液滴定生成的碘,消耗VmL.已知: I2+2S2O32-=2I-+S4O62-,样品中氯元素的质量分数=__________%
【答案】氢氧化钠溶液 吸收多余氯气,防止污染空气 ![]() 该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低产品溶解度 (CNO)3Na3 NaCl
该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低产品溶解度 (CNO)3Na3 NaCl ![]() 1.775V
1.775V
【解析】
由图中装置和实验药品可知,A装置为氯气发生装置,B装置发生氯化反应生成DCCA,C装置用于尾气处理,吸收多余的氯气。利用DCCA生产DCCNa先将B中产物主要成分为DCCA和NaCl的混合物进行过滤洗盐,得到DCCA,DCCA与氢氧化钠反应得到DCCNa,再经过冷却结晶,过滤干燥得到产品DCCNa,以此分析。
(1)由上述分析可知C装置用于尾气处理,吸收多余的氯气,防止污染空气,试剂为氢氧化钠溶液,故答案为:氢氧化钠溶液;吸收多余氯气,防止污染空气;
(2)A装置为氯气发生装置离子反应为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)由已知反应可知装置B中反应![]() ,该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低温度可降低产品溶解度;(CNO)3H3 (氰尿酸)为三元弱酸,则碱溶时若氢氧化钠过量,则会生成产物(CNO)3Na3,故答案为:该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低产品溶解度;(CNO)3Na3;
,该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低温度可降低产品溶解度;(CNO)3H3 (氰尿酸)为三元弱酸,则碱溶时若氢氧化钠过量,则会生成产物(CNO)3Na3,故答案为:该反应放热,冰水浴可降温促进反应向正反应方向进行,同时降低产品溶解度;(CNO)3Na3;
(4)B中产物主要成分为DCCA和NaCl的混合物,则过滤洗盐洗去的盐是NaCl,故答案为:NaCl;
(5)DCCA与氢氧化钠反应得到DCCNa化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(6)DCCNa样品,加入一定量醋酸溶液溶解,样品中的氯元素全邵转化成HClO,再加入足量的KI溶液,用Na2S2O3标准溶液滴定生成的碘,则关系式为:![]() ,则氯原子的物质的量
,则氯原子的物质的量![]() ,则样品中氯元素的质量分数为
,则样品中氯元素的质量分数为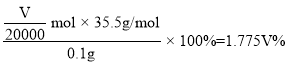 ,故答案为:1.775V。
,故答案为:1.775V。


科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)相同质量的CO和CO2,它们所含的原子数之比为___________,标准状况下,含有相同氧原子数的CO和CO2的体积之比为_____________。
(2)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(3)标准状况下有①0.112 L水 ②0.5NA个HCl分子 ③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne 所含原子个数从大到小的顺序为___________。
(4)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出![]() mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________________。(用含有m、V的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________。
(3)E的最高价氧化物分子的空间构型是__________,是____分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________。(a)中E原子的配位数为____。
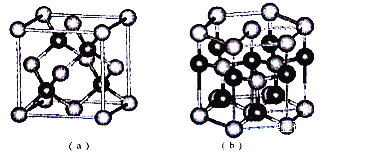
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4NA个电子
B.1 L 0.1 mol·L-1的氨水中有0.1NA个NH4+
C.标准状况下,22.4 L盐酸含有NA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+,Na+,![]() ,Mg2+,Fe3+,Al3+,
,Mg2+,Fe3+,Al3+,![]() ,
,![]() 等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法不正确的是( )
等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法不正确的是( )
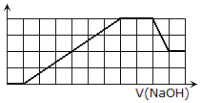
A.原溶液中含有的阳离子是H+,![]() ,Mg2+,Al3+
,Mg2+,Al3+
B.原溶液中一定含有![]() ,一定不含
,一定不含![]()
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质除了Na2SO4外还有其它物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoS2催化CO烟气脱硫具有广阔的工业化前景。回答下列问题:
(1)已知:
CoS2(s) +CO(g) ![]() CoS(s) +COS(g) H1
CoS(s) +COS(g) H1
2COS(g) +SO2(g) ![]() 3S(s) +2CO2(g) H2
3S(s) +2CO2(g) H2
S(s) +CoS(S) ![]() CoS2 (s) △H3
CoS2 (s) △H3
则2CO(g)+ SO2(g)![]() 2CO2(g)+S(s) H4=____。 (用H1、 H2、H3表示)
2CO2(g)+S(s) H4=____。 (用H1、 H2、H3表示)
(2)在恒温、恒压的容器中模拟回收硫,加入SO2起始量均为1mol,测得CO2的平衡体积分数随CO和SO2的投料比变化如图:

①当投料比为2时,t min 时测得SO2转化率为50%,则用S的生成速率表示的反应速率v=______g·min-1。
②当投料比为3时,CO2 的平衡体积分数对应的点是______________。
(3)向体积均为1L的恒温、恒客密团容器通入2 mol CO和| mol SO2。反应体系总压强随时间的变化如图:
①相对于I,II改变的外界条件是____________________。
②SO2的平衡转化率为______,平衡常数Kp =________(用平衡分压代替平衡浓度计算)。
(4)利用电解法处理SO2尾气可制备保险粉 (Na2S2O4).电解装置如图,则a____ b (填“>” “=”或“<”),生成S2O42-的电极反应式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是合成磷酸氨喹的中间体,一种合成路线如下:

回到下列问题:
(1)A中的官能团名称是______________。
(2)C的化学名称为____________。
(3)⑦的反应类型是_____________。
(4)已知③为取代反应,另一生成物为乙醇,E的结构简式为__________。
(5)写出G到H的反应方程式______________。
(6) H在一定条件下可以转化为(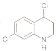 ),请写出任意一 种同时符合下列条件M的同分异构体_____________________。
),请写出任意一 种同时符合下列条件M的同分异构体_____________________。
①含苯环且苯环上有3个取代基
②含有NH2,能发生加聚反应
③核磁共振氢谱图为6组峰,峰面积比为1:1:1:2:2:2
(7)设计以对羟基苄氯(![]() )、CH3CH2OH为主要原料制备(
)、CH3CH2OH为主要原料制备(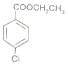 )的合成路线(无机试剂任选)。_________。
)的合成路线(无机试剂任选)。_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶油中含有一种化合物A,可用作香料。在空气中长时间搅拌奶油,A可转化为化合物B。A发生的一系列化学反应如下:

完成下列填空:
(1)写出反应类型:反应 ①_________________________反应 ②_________________________
(2)写出反应③所需的试剂与条件:_________________________________
(3)写出结构简式:F________________________
(4)写出一种满足下列要求的A的同分异构体的结构简式:_______________________
i.含有酯基 ii.能发生银镜反应
(5)写出C→D反应的化学方程式:________________________________________________
(6)C也能与乙二酸反应形成环状化合物(C6H8O4),写出该环状化合物的结构简式:__________
(7)写出以C为原料合成1,4-丁二醇(![]() )的合成路线__________。(合成路线常用的表示方式为:
)的合成路线__________。(合成路线常用的表示方式为:![]()
![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物X、Y和高聚物Z,可以用烃A为主要原料,采用以下路线:
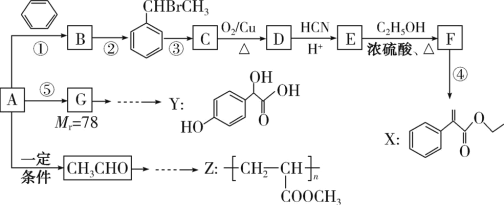
已知:I.反应①、反应②均为加成反应
II. 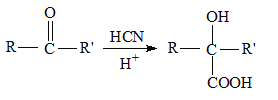 (R和R' 可以是烃基或H原子)请回答下列问题:
(R和R' 可以是烃基或H原子)请回答下列问题:
(1)CH3CHO分子中碳原子的杂化方式为_______________,CH3CH2OH的沸点明显高于CH3CHO的原因是________________________。
(2)A的名称为________________,X的分子式为________________________。
(3)关于药物Y(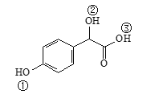 )中①、②、③ 3个-OH的酸性由弱到强的顺序是____________________。
)中①、②、③ 3个-OH的酸性由弱到强的顺序是____________________。
(4)写出反应C→D的化学方程式:___________。E→F的化学方程式: ____________。
(5)参考上述流程以CH3CHO和CH3OH为起始原料,其它无机试剂任选设计合成Z的路线流程图:_____________________。合成路线流程图示例:H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3CH2Br
CH3CH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com