
【题目】现将浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=60mL)。下列叙述错误的是 ( )

A. 实验的环境温度低于22℃ B. 混合溶液的导电能力:M>N
C. P点混合溶液呈中性 D. 若将H2SO4改为CH3COOH,P点温度低于28℃
【答案】B
【解析】A项,M点温度为22℃,此时是5mL硫酸溶液和55mLNaOH溶液混合反应放热,则实验的环境温度低于22℃(或N点温度为22℃,此时是55mL硫酸溶液和5mLNaOH溶液混合反应放热,则实验的环境温度低于22℃),正确;B项,M点是等浓度5mL硫酸溶液和55mLNaOH溶液混合,N点是等浓度55mL硫酸溶液和5mLNaOH溶液混合,由于硫酸为二元强酸,NaOH为一元强碱,充分反应后N点溶液中离子浓度大于M点溶液中离子浓度,混合溶液的导电能力:N![]() M,错误;C项,P点加入等浓度的20mL硫酸溶液和40mLNaOH溶液,两者恰好完全反应生成Na2SO4,溶液呈中性,正确;D项,若将硫酸改为醋酸,由于醋酸电离吸热,P点温度低于28℃,正确;答案选B。
M,错误;C项,P点加入等浓度的20mL硫酸溶液和40mLNaOH溶液,两者恰好完全反应生成Na2SO4,溶液呈中性,正确;D项,若将硫酸改为醋酸,由于醋酸电离吸热,P点温度低于28℃,正确;答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-===Fe2+
B.铜制品和钢铁制品一样能发生析氢腐蚀
C.常温下钢铁在浓硝酸溶液中不会发生析氢腐蚀
D.钢铁发生析氢腐蚀时,H+得电子释放出H2,钢铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:

回答下列问题:
(1)Ni2O3中Ni的化合价为___________________________________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是_________________________。
(3)加入H2O2“氧化”的离子方程式为_________________________________________;滤渣A的主要成分是________________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________________________________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )
A.化学反应前后质量守恒B.低温下分子无法运动
C.温度降低,化学反应停止D.温度越低,化学反应越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④B.①③④②
C.③④②①D.③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二水氯化钡晶体(BaCl22H2O)在工业上主要用于制造各种钡盐、颜料和有机染料,某研究小组以重晶石(主要成分 BaSO4)制备BaCl22H2O 流程如下图。
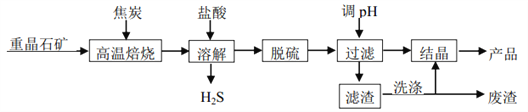
(1)已知:
① BaSO4(s)+ 4C(s)= 4CO(g) + BaS(s) △H1 = 571.2kJmol﹣1
② C(s)+ CO2(g)= 2CO(g) △H2 = 172.5 kJmol﹣1
反应 BaSO4(s)+ 2C(s)= 2CO2(g)+ BaS(s)的△H = _____ kJmol﹣1
(2)高温焙烧须加入过量的炭,同时还要通入空气,其目的是_____、_____。
(3)脱硫过程中分为两步, 第一步是物理脱硫, 第二步是化学脱硫。
① 物理脱硫是直接用蒸汽升温,并用空气“爆气法”除去的物质是_____。
② 下列物质不宜用作脱硫剂的是_____ (填字母)。
A. 高锰酸钾 B. 次氯酸钠 C. 双氧水 D.氯气
(4)上述流程中洗涤滤渣的主要目的是_____。
(5)溶解时产生的 H2S 可用 80~85 ℃时的石灰氮料浆(CaCN2的浆水混合物)吸收并制得更有价值的产品——硫脲[CS(NH2)2]和熟石灰。请写出制备硫脲的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、 MgSiO3以及铁和铝的氧化物)为原料制备MgCO33H2O。实验流程如下: [已知当溶液的pH=8.5时, Mg(OH)2开始沉淀]
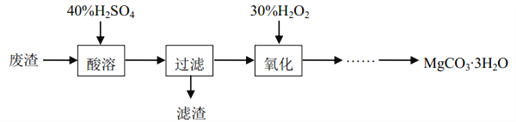
(1)滤渣的主要成分是______(填化学式)。
(2)氧化的目的是__________。
(3)由氧化后得到的溶液经除杂后,滴加适量的Na2CO3溶液便可制得MgCO33H2O。滴加Na2CO3溶液时,不能太快也不能过量的原因是_______________。
(4)通过测定产品中的镁含量和碳含量可判断质量的优劣。现称取3.00 g某学生制得的产品溶于足量的稀盐酸中收集到448 mLCO2气体(假设气体全部逸出并折算为标准状况 ),再将所得溶液稀释至250 mL,取 出25 mL,向其中滴加0.1000 mol·L-1的EDTA(Na2H2Y)溶液至恰好完全反应时消耗体积为23.10 mL。(离子方程式为Mg2++H2Y2-=MgY2-+2H+)通过计算,分别确定镁含量和碳含量比理论值偏高还是偏低?_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.01×1023个X气体分子的质量为16 g,则X气体的摩尔质量是
A. 16 g B. 32 g C. 64 g /mol D. 32 g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置. 
请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)装置A的烧瓶中可装试剂
(3)B装置的名称是 , E装置的作用 .
(4)通入C装置的两根导管左边较长、右边较短,目的是 .
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.写出反应的化学方程式:该反应中氧化剂和还原剂的物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com