
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2molL的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
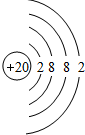 .
.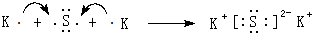 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 |
| n(HI) | 1 | 0.91 | n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 104克苯乙烯所含碳碳双键数为4NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是良好的半导体材料 | B. | 硅常温时可以和强碱反应 | ||
| C. | 二氧化硅广泛存在于自然界 | D. | 硅酸是挥发性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在“阿司匹林的合成”实验中,把从盐酸中析出的晶体进行抽滤,用乙醇洗涤晶体1~2次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率 | |
| B. | 制备摩尔盐时,最后在蒸发皿中蒸发浓缩溶液,加热至液体表面出现晶膜为止,不能溶液全部蒸干 | |
| C. | 晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越高,或溶剂的蒸发速度越快,析出的晶粒就越细大 | |
| D. | 在“食醋总酸含量测定”实验中,将食醋稀释10倍后再滴定是为了减少食醋的浪费 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com