
| A. | 次氯酸的结构式:H-Cl-O | B. | 中子数为1的氢原子:${\;}_{1}^{1}$H | ||
| C. | 甲基的电子式: | D. | CO2的比例模型: |
分析 A.次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.甲基中含有3个碳氢键,碳原子最外层为7个电子;
D.比例模型表示原子的相对大小及原子连接顺序、空间结构.
解答 解:A.次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合,结构式为H-O-Cl,故A错误;
B.中子数为1的氢原子质量数为2,该核素正确的表示方法为:21H,故B错误;
C.甲基为中性原子团,其电子式为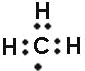 ,故C正确;
,故C正确;
D.二氧化碳的分子式为CO2,二氧化碳为直线型结构,其比例模型中碳原子的相对体积大于氧原子,二氧化碳正确的比例模型为 ,故D错误;
,故D错误;
故选C.
点评 本题考查常用化学用语的表示方法,题目难度不大,涉及比例模型、电子式、元素符号、结构式等知识,明确常见化学用语的概念及书写原则为解答关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝有多种化合物,在工业上用途广泛.氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN+H2O+NaOH→NaAlO2+NH3↑)
铝有多种化合物,在工业上用途广泛.氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN+H2O+NaOH→NaAlO2+NH3↑)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 浓硝酸与铜反应制取二氧化氮 | B. | 碳化钙与食盐水反应制取乙炔 | ||
| C. | 浓氨水和生石灰反应制取氨气 | D. | 浓盐酸和二氧化锰反应制取氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol•L-1 | B. | 2.25 mol•L-1 | C. | 3 mol•L-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 水溶液中Fe2+、H+、SO${\;}_{3}^{2-}$、ClO-不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com