
化学实验的微型化可有效减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体中滴加一滴浓盐酸,再立即将表面皿盖好。[已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
(1)e处反应的离子方程式为 ,该反应中发生反应的氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象为 ,d处的实验现象为 。
(3)c处反应的化学方程式为 ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? (填“能”或“不能”),若能,其氧化性由强到弱的顺序是 。
科目:高中化学 来源: 题型:填空题
(8分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓) = 2SO2↑+SeO2+2H2O 2SO2+SeO2+2H2O = Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 = Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: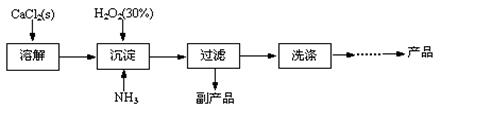
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型
与氧化还原反应的关系”也可用如图表达。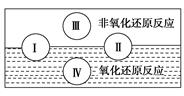
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)(2011·福建高考卷节选)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学知识在各个领域应用广泛。如:
(1)2003年10月15日,我国成为世界上第三个将人送入太空的国家,这次载人航天发射使用
的“长征”二号火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮为氧化剂,燃烧主要产生CO2、N2等气体,放出的巨大能量把火箭送入太空。反应的化学方程式为: 。(2分)
(2)管道工人曾经用浓氨水检验氯气管道。如果氯气管道某处漏气,会出现白烟现象。氨与氯
气反应的化学方程式为: 。(2分)出现白烟现象的化学方程式为: 。(2分)
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。工业生产ClO2过程是将食盐
水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。反应的化学方程式为: 。(2分)
(4)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的。这一过程中发生反应的化学方
程式为: 。(2分)
(5)维生素C在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+。这说明维生素C具有 。(填“氧化性”或“还原性”)(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将5.5 g铁铝混合物粉末加入900mL 1.00 mol/L HNO3溶液中,充分反应后,得a L(标准状况)NO气体。
(1)HNO3是否过量___________。
(2)若a=3.36L(标准状况),则混合物中铝的质量分数为_________%。
(3)若a=3.36L(标准状况),往反应后的溶液中加入___________ mL 1.000 mol/L NaOH溶液时生成的沉淀量最大,还要加________ mL 1.000 mol/L NaOH溶液才能使沉淀的量保持不变。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)
__________ _____________________________________________________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。说出NaBiO3的一个性质:
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-=NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:__________________________________。
(2)反应中硝酸体现了______________、______________的性质。
(3)反应中若产生0.2 mol气体,则转移的电子的物质的量是________ mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是: ;
②写出由CaCl2通过化合反应制备CaCl的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com