
| A、①②③④⑤⑥ |
| B、④③⑥⑤①② |
| C、③⑥⑤④①② |
| D、③⑥⑤①④② |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| A、盐酸与氨水反应 H++OH-═H2O |
| B、硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
| C、硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag |
| D、铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 对叔丁基杯芳烃的合成原理如下,装置如图:
对叔丁基杯芳烃的合成原理如下,装置如图: +4HCIHO
+4HCIHO| Naoh,二苯醚 |
| 4h |
 +4H2O
+4H2O查看答案和解析>>
科目:高中化学 来源: 题型:
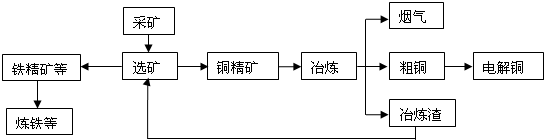
| ||
| 物 质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3可与水反应生成Al(OH)3 |
| B、铝是人类使用最早的金属之一 |
| C、Al2O3是碱性氧化物 |
| D、Al(OH)3沉淀可以溶于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、SiO32-、NO3-、CO32- |
| B、K+、Cl-、MnO4-、SO42- |
| C、Na+、NO3-、SO42-、HCO3- |
| D、Na+、SO42-、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
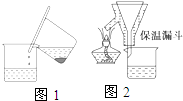 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
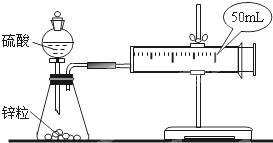 两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com