
【题目】(1)请用化学方程式写出如何检验牙膏中存在甘油的方法___。
(2)Ca3N2是离子化合物,各原子均满足8电子稳定结构。写出Ca3N2的电子式___。
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1mol硼酸(H3BO3)晶体中含有___mol氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:___。

【答案】CH2OH-CHOH-CH2OH+Cu(OH)2![]()
 +2H2O
+2H2O  3 H3BO3分子之间形成氢键,使硼酸缔合成层状大分子,在冷水中溶解度小,而热水中H3BO3分子之间形成氢键被破坏,H3BO3分子与水分子之间形成大量的氢键,增大了溶解度
3 H3BO3分子之间形成氢键,使硼酸缔合成层状大分子,在冷水中溶解度小,而热水中H3BO3分子之间形成氢键被破坏,H3BO3分子与水分子之间形成大量的氢键,增大了溶解度
【解析】
(1)甘油与新制氢氧化铜反应生成绛蓝色的溶液,因此可用来检验牙膏中存在甘油,方程式为CH2OH-CHOH-CH2OH+Cu(OH)2![]()
 +2H2O;
+2H2O;
(2)Ca3N2是离子化合物,各原子均满足8电子稳定结构,因此Ca3N2的电子式为 ;
;
(3)1个H3BO3周围形成6个氢键,每个氢键为1个H3BO3贡献率为![]() ,即1个H3BO3单独占有氢键数目为6×
,即1个H3BO3单独占有氢键数目为6×![]() =3,故1mol H3BO3晶体中含有3mol氢键;H3BO3分子之间形成氢键,使硼酸缔合成层状大分子,在冷水中溶解度小,而热水中H3BO3分子之间形成氢键被破坏,H3BO3分子与水分子之间形成大量的氢键,故硼酸在冷水中的溶解度小而加热时溶解度增大。
=3,故1mol H3BO3晶体中含有3mol氢键;H3BO3分子之间形成氢键,使硼酸缔合成层状大分子,在冷水中溶解度小,而热水中H3BO3分子之间形成氢键被破坏,H3BO3分子与水分子之间形成大量的氢键,故硼酸在冷水中的溶解度小而加热时溶解度增大。


科目:高中化学 来源: 题型:
【题目】铜与锌用导线连接后,插入稀硫酸中形成原电池。
(1)分析图并填空:__。
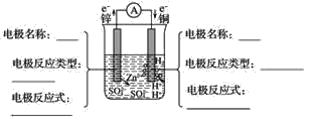
(2)原电池总反应式(离子方程式)__。
(3)上述装置产生电流的原因是__。
(4)上述装置的能量转化是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A.c(H3PO4)=![]() mol/L
mol/L
B.c(H+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )+c(OH-)
)+c(OH-)
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH2PO4固体,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,在一定的条件下,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2B.若甲为Fe,则丁可能是氯气
C.若甲为Fe,则丁可能是硝酸D.若甲为NaOH 溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+![]()
②![]() +2
+2![]() =
=![]() +3I-
+3I-
现取某20.00mL含Cu2+的溶液。加入足量的KI充分反应后,用0.1000mo1·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液体积如表所示。
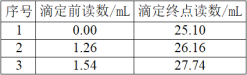
(1)溶液中Cu2+的浓度为___mol·L-1。
(2)用移液管量取20.00mLCu2+的溶液时俯视刻度线,最终测得的Cu2+的浓度将___(“偏高、偏低或无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式___________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
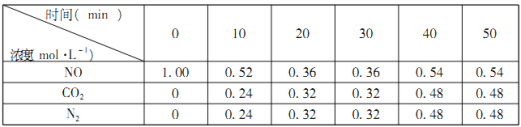
①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是___________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后,再充入少量NO气体,再次达到平衡时N2的浓度 ____________(填“增大”,“减小”,或“不变”)
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O5 2mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
(4)在一定温度下,有a、硫酸氢钠b、硫酸c、醋酸三种溶液,若三者c(H+)相同时,物质的量浓度由大到小的顺序是_____,当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几个离子反应:
① Cr2O![]() +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O
② 2Fe2++Br2===2Fe3++2Br- ③ 2Br-+Cl2=== Br2+2Cl-
④ 2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
下列有关性质的比较中正确的是( )。
A. 氧化性:Cr2O![]() >Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O
>Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O![]()
C. 还原性:SO2<Fe2+<Br- D. 还原性:Cl->Cr3+>Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
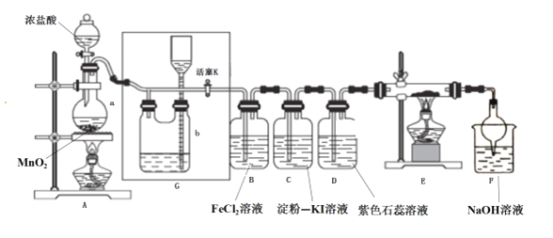
(1)A中发生反应的化学反应方程式为________________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置D中能看到的实验现象分别是 ___________________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)B处发生反应的离子方程式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com