
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)固体样品加热时,反应的化学方程式为___________________。
(2)能否用Ba(NO3)2代替BaCl2________,理由是_______________________________。
(3)证明![]() 沉淀完全的方法是___________________________________________。
沉淀完全的方法是___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(四)化学试卷(A卷)(解析版) 题型:推断题
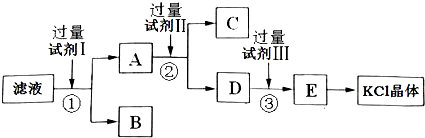
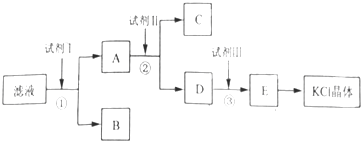
[2012·全国卷](12分)氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。
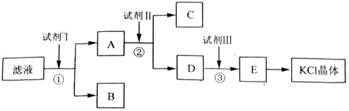
回答下列问题:
(1)起始滤液的pH_ _7(填“大于”、“小于”或“等于”),其原因是____________;
(2)试剂Ⅰ的化学式为______,①中发生反应的离子方程式为___________ ______;
(3)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是____________ ________;
(4)试剂Ⅲ的名称是________,③中发生反应的离子方程式为_________ ____;
(5)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用0.100 0 mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为_________________________________(列式并计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com